解决疾病根源!RNAi疗法lumasiran治疗原发性高草酸尿症1型(PH1):将尿草酸水平显著降低65%!
来源:本站原创 2020-06-08 20:15
lumasiran正在接受美国和欧盟的审查,该药有潜力成为第一个解决PH1根本病因的药物!

2020年06月08日讯 /生物谷BIOON/ --Alnylam制药公司是RNAi疗法开发领域的全球领导者,其药物Onpattro(patisiran,静脉制剂)于2018年8月获批,成为RNAi现象被发现整整20年以来获准上市的首款RNAi药物。2019年11月,Givlaari(givosiran,皮下制剂)获批,成为全球获批的第二款RNAi药物,同时也是GalNAc偶联RNA疗法的全球首次批准,标志着精密基因药物开发的一个重大里程碑。
近日,Alnylam公司公布另一款RNAi药物lumasiran治疗原发性高草酸尿症1型(PH1)III期ILLUMINATE-A研究(NCT03681184)的阳性结果。结果显示,lumasiran显著减少了肝脏中草酸的生成,同时展示出令人鼓舞的安全性和耐受性。详细数据见:ILLUMINATE-A研究报告。
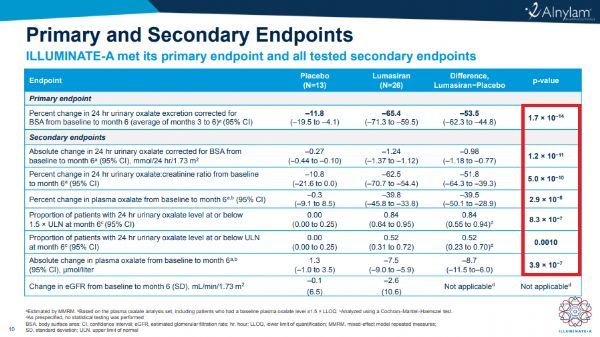
ILLUMINATE-A是一项随机、双盲、安慰剂对照试验,在全球八个国家16个临床中心入组了30例年龄≥6岁的PH1患者,这是在PH1群体中开展的最大规模的介入研究。研究中,患者以2:1的比例被随机分配,接受lumasiran或安慰剂治疗。lumasiran按3mg/kg剂量给药,每月一次治疗3个月,然后按每季度一次维持剂量。主要终点是,与安慰剂组相比,lumasiran治疗组在第3至6个月期间24小时尿草酸排泄量与基线相比的百分比变化。
结果显示,研究达到了主要终点:lumasiran与安慰剂相比将尿草酸排泄量平均减少53.5%(p=1.7x10E-14)、将尿草酸排泄量从基线平均降低65.4%。此外,该研究在全部测试次要终点方面也取得了统计学上显著的结果,包括lumasiran治疗组尿草酸接近正常化(84%)或正常化(52%)的患者比例,而安慰剂组为0%。lumasiran给药具有令人鼓舞的安全性和耐受性,没有严重的不良事件,最常见的药物相关不良反应是轻微的注射部位反应(ISR)。
Alnylam公司研发总裁Akshay Vaishnaw博士表示:“我们非常高兴地报告ILLUMINATE-A研究的阳性结果。该研究中,尿草酸和血浆草酸的大量持续减少表明,lumasiran通过减少导致这种严重进行性疾病临床表现的有毒代谢物的产生,解决了PH1的内在病理生理学问题。因此,我们相信lumasiran有潜力对疾病表现产生有利影响,包括肾钙质沉着症和肾结石,以及整体疾病进展,我们将在正在进行的ILLUMINATE项目中继续对其进行评估。ILLUMINATE-A研究代表了一种RNAi疗法的第6个阳性III期研究,我们认为它进一步突出了这种模式作为一种全新的药物类别的转化潜力。如果获得监管批准,我们期待将lumasiran带到世界各地的PH1患者。”
荷兰阿姆斯特丹大学阿姆斯特丹医学中心Emma儿童医院儿科肾脏科主任Jaap Groothoff医学博士表示:“在PH1患者中,草酸的持续过量产生会对肾脏和其他器官产生毁灭性的影响。目前的疾病管理策略旨在减轻对肾脏的损害,肝移植是纠正代谢缺陷和使高草酸生成正常化的唯一手段。随着患者接近终末期肾病,他们可能需要进行强化透析,作为进行肝/肾双重移植的桥梁。根据ILLUMINATE-A研究的结果,lumasiran显示出显著抑制草酸过量产生的潜力,草酸过量产生是PH1进行性肾功能衰竭的原因。肝脏草酸生成的减少有潜力给PH1患者带来临床益处,并有潜力改变病程。”
PH1是一种超级罕见、进行性、毁灭性疾病,影响肾脏和其他重要器官,该病由过量的草酸生成引起,尿草酸水平升高与进展到终末期肾病和其他全身并发症相关。PH1可导致肾衰竭,具有显著的发病率和死亡率,目前尚无批准的治疗方法。该病影响婴儿、儿童和成人,患者面临着反复和痛苦的结石事件,以及肾功能进行性和不可预测的下降,最终导致终末期肾病,需要进行强化透析,作为肝/肾双重移植的桥梁。PH1通常在儿童期发病,需要立即进行有效的干预,晚期患者除了透析之外别无选择,而肝移植是目前唯一解决疾病根源的治疗方法。
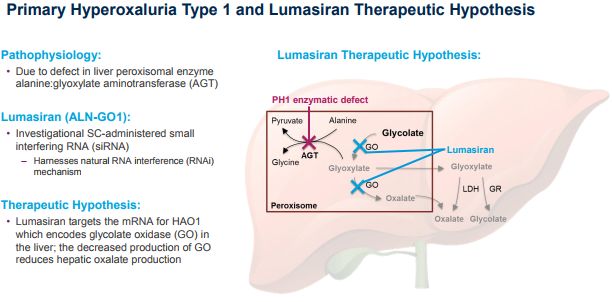
lumasiran是一种靶向羟基酸氧化酶1(HAO1)的皮下注射RNAi药物,开发用于原发性高草酸尿症1型(PH1)的治疗。HAO1编码乙醇酸氧化酶(GO)。因此,通过沉默HAO1和消耗GO酶,lumasiran可抑制肝脏中草酸(直接参与PH1病理生理学的代谢物)的产生并使其正常化,从而潜在地阻止PH1疾病的进展。
lumasiran是第一种显示出显著减少尿草酸排泄量的疗法。来自III期ILLUMINATE-A研究的结果证实,lumasiran显著减少了肝脏中草酸的生成,有潜力解决PH1的内在病理生理学问题,并有潜力对PH1患者产生有意义的临床影响。
基于ILLUMINATE-A研究的结果,Alnylam在美国和欧盟提交了lumasiran治疗PH1的上市申请。目前,该药正在接受美国FDA的优先审查和欧盟EMA的加速评估。在美国,lumasiran已被FDA授予治疗PH1的儿科罕见病资格、孤儿药资格(ODD)、突破性药物资格(BTD)。在欧盟,lumasiran已被授予孤儿药资格(ODD)、优先药物资格(PRIME)。这些资格认定,共同强调了lumasiran解决PH1潜在病理生理学问题的潜力。
lumasiran采用了Alnylam公司最新的增强稳定化学ESC-GalNAc共轭技术开发,该技术可使皮下给药具有更强的效力和持久性,并具有一个宽泛的治疗指数。目前,Alnylam公司正在开展另外两项全球性III期研究:(1)ILLUMINATE-B,评估lumasiran治疗年龄<6岁的PH1患者,预计2020年年中获得结果;(2)ILLUMINATE-C,评估lumasiran治疗伴有晚期肾脏病的所有年龄段PH1患者,预计2021年获得结果。(生物谷Bioon.com)
原文出处:Alnylam Presents Positive Phase 3 Results from ILLUMINATE-A Study of Lumasiran, an Investigational RNAi Therapeutic for Treatment of Primary Hyperoxaluria Type 1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->