全身型重症肌无力(gMG)新药!阿斯利康长效C5抑制剂Ultomiris在美国进入优先审查:1周起效、疗效持续52周!
来源:本站原创 2021-12-22 22:10
Ultomiris有潜力成为gMG的新护理标准。
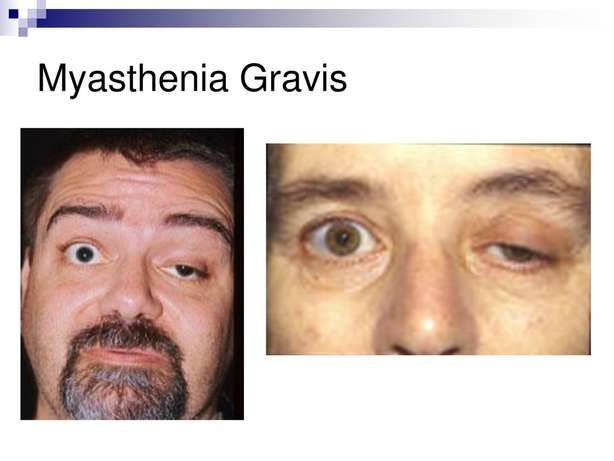
重症肌无力(图片来源:10faq.com)
2021年12月20日讯 /生物谷BIOON/ --阿斯利康(AstraZeneca)近日宣布,美国食品和药物管理局(FDA)已受理长效C5补体抑制剂Ultomiris(ravulizumab,雷夫利珠单抗)治疗全身型重症肌无力(gMG)成人患者的补充生物制品许可申请(sBLA)并进行优先审查。在阿斯利康罕见病部门亚力兄(Alexion)使用了一种罕见病优先审查凭证(PRV)后,FDA已指定该sBLA的《处方药用户收费法(PDUFA)》目标日期为2022年第二季度。
目前,Ultomiris治疗gGM的监管申请也正在接受欧盟和日本监管机构的审查。全身型重症肌无力(gMG)是一种罕见的、使人虚弱的慢性自身免疫性神经肌肉疾病,可导致神经肌肉功能丧失和严重虚弱。在美国,估计有64000例gMG患者。
Alexion首席执行官Marc Dunoyer表示:“C5补体抑制剂Soliris(eculizumab,依库珠单抗)是近60年来第一个被批准用于治疗这种毁灭性疾病的新疗法,Ultomiris治疗gMG的新适应症申请,体现了Alexion继续致力于改善gMG患者的预后。3期试验表明,Ultomiris可以帮助范围更广的患者,包括症状较轻或处于治疗旅程早期的患者。”
在美国,Ultomiris治疗gMG的sBLA,基于一项3期临床试验的阳性结果。Alexion于2021年7月公布了相关数据,结果显示:Ultomiris早在治疗第1周就显示出疗效,并持续52周(26周随机对照期+26周开放标签扩展期)。具体而言,接受Ultomiris治疗的患者,显示重症肌无力-日常生活能力量表(MG-ADL,一种患者报告评估)总评分较基线的变化有高度的统计学意义,并且对于迄今为止已完成26周扩展研究的患者子集,总共治疗52周后仍保持阳性疗效。该研究中,Ultomiris耐受性良好,安全性与阵发性夜间血红蛋白尿(PNH)和非典型溶血性尿毒综合征(aHUS)的3期研究一致。
近年来,gMG治疗领域发展迅速,但仍存在着未满足的医疗需求。来自Ultomiris 3期研究的结果,加强了补体抑制在治疗gMG中的关键作用,这将为更多的患者提供机会,采用一种具有保护神经肌肉功能作用机制的药物进行早期治疗。
Soliris的批准上市是解决重症肌无力(MG)严重症状和并发症患者迫切治疗需求的重要第一步,也是60多年来这一毁灭性疾病的第一个新疗法。上述3期研究结果表明,Ultomiris可以帮助到比Soliris 3期试验更广泛的患者,包括那些症状较轻或处于病程早期的患者,同时仍然可以提供临床上有意义的益处,这些益处最早在第一周就观察到,并维持到52周。这些数据表明,Ultomiris有潜力成为gMG的新护理标准,并可能通过其延长的给药间隔减轻患者的治疗负担,从而提高治疗依从性和患者满意度。
2020年12月,阿斯利康宣布390亿美元现金加股票形式收购Alexion。这笔收购于2021年7月成功完成。此次收购是阿斯利康于1999年由英国和瑞典的两家制药商合并成立以来开展的最大一笔收购。该项收购的成功完成标志着阿斯利康进入了罕见病药物领域,开启了阿斯利康的新篇章。
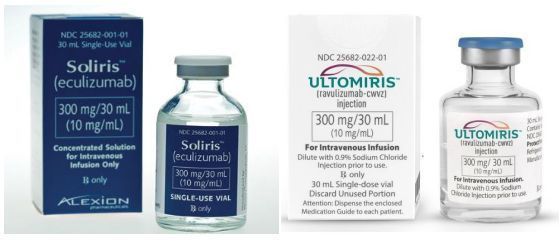
Alexion公司的主打产品是2款补体C5抑制剂Soliris和Ultomiris,后者是前者的长效版。2款药物均通过抑制补体级联反应终端部分的C5蛋白发挥作用。补体级联反应是免疫系统的一部分,其不受控激活在多种严重的罕见病和超级罕见病中发挥了重要作用。
Soliris于2007年首次获准上市,目前已批准多种超级罕见病,包括:阵发性睡眠性血红蛋白尿(PNH)、非典型溶血尿毒症综合征(aHUS)、全身型重症肌无力(gMG)、视神经脊髓炎谱系障碍(NMOSD)。Ultomiris是Soliris的升级版产品,是第二代、长效C5补体抑制剂,于2018年底首次获批上市,已批准的适应症包括:PNH、aHUS。
Soliris是全球最畅销的罕见病药物之一,2020年销售额达到了40.65亿美元。Ultomiris在2020年的销售额已达到了10.77亿美元。2款C5抑制剂的销售总额达51.42亿美元。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


