Nature Communication:自噬蛋白ATG9A能够从脂滴中动员脂质
来源:本站原创 2021-11-29 13:15
多跨膜蛋白ATG9A是一种扰乱酶,在两个膜小叶之间翻转磷脂,从而在自噬的早期阶段促进吞噬体膜的扩张。
多跨膜蛋白ATG9A是一种扰乱酶,在两个膜小叶之间翻转磷脂,从而在自噬的早期阶段促进吞噬体膜的扩张。在这里,作者表明ATG9A的缺失不仅抑制了自噬,而且还增加了人类细胞系ANDC中脂滴的大小和/或数量。此外,ATG9A的耗尽阻止了脂肪酸从脂滴到线粒体的转移,从而阻止了脂肪酸在线粒体呼吸中的利用。
ATG9A定位于泡状管状簇(VTC),VTC与富含在另一种多跨膜扰乱酶TMEM41B中的ER亚域紧密相关,也与吞噬细胞、脂滴和线粒体密切相关。这些结果表明ATG9A在从脂滴到自噬小体和线粒体的脂质动员过程中起着关键作用,突出了ATG9A在自噬和非自噬过程中的重要性。
图片链接:https://doi.org/10.1038/s41467-021-26999-x
自噬是一种分解代谢过程,在这个过程中,细胞质物质被吞噬成双膜自噬小体,最终与溶酶体融合,被溶酶体酸性水解酶降解。这一过程始于杯状自噬前结构的从头形成,称为“吞噬载体”或“隔离膜”,与内质网(ER)富含磷脂酰肌醇的亚区(称为“omegasome”)紧密结合在一起。这一过程被称为“吞噬载体”或“隔离膜”,与内质网(ER)中富含磷脂酰肌醇的亚域(称为“omegasome”)密切相关。
这种联系涉及内质网和吞噬体间的膜连续性或膜接触点(MCS),使磷脂能够转移到噬菌体的膜上。其他ER亚域,如ER出口位点(ERES)或细胞器,如ER-高尔基复合体(ERGIC)、高尔基复合体、脂滴(LDS)、线粒体、内小体、溶酶体和质膜,通常位于新生吞噬细胞的附近,也可能有助于吞噬细胞的生长和成熟。
在新生的吞噬细胞附近,常可发现其他ER亚域,如ER出口位点(ERES)或细胞器(如ERGIC)、高尔基复合体、脂滴(LDS)、线粒体、内小体、溶酶体和质膜。吞噬体膜经历快速膨胀,同时通过atg8家族蛋白和货物受体隔离细胞质物质,直到其关闭为成熟的自噬小体。
对自噬早期步骤的形态和功能的剖析已被证明是困难的,因为吞噬体膜富含磷脂,但缺乏可作为这一过程的标志物的完整的膜蛋白。磷脂主要是在内质网的胞质小叶上合成的,这与这个细胞器是吞噬体膜扩张的主要来源是一致的。特别是在ER-噬菌体界面的磷脂的局部合成似乎对这一过程至关重要。
磷脂转运到吞噬体膜所涉及的蛋白质的特性直到最近才开始出现。VMP1和TMEM41B是两种内质网相关的跨膜扰乱酶,它们介导跨双层磷脂转运并随后输送到吞噬体膜。此外,胞浆蛋白ATG2(在人类中以两种类似蛋白ATG2A和ATG2B存在)作为磷脂在内质网和吞噬体膜之间运输的管道。
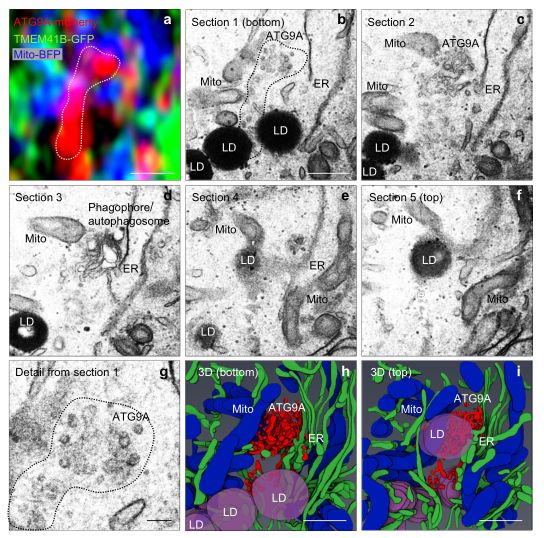
ATG9A相对其他细胞器定位的相关光电子显微镜观察。
图片来源: https://doi.org/10.1038/s41467-021-26999-x
在这项研究中,作者调查了人类ATG9A是否在细胞内脂质稳态中发挥作用,特别是与LDS有关。结果表明,在人类细胞中,ATG9A基因的敲除(KO)或敲除(KD)导致LDs的数量和大小增加,FA从LDs到线粒体的转运受阻,线粒体FAβ氧化减少。相反,另一种在自噬后期发挥作用的蛋白质ATG7的KO不影响LD丰度和线粒体FA转运和β氧化,表明ATG9A-KO细胞中LD和FA代谢缺陷不是由于LDs自噬降解受阻所致。
作者还证明了ATG9A VTCs与内质网中富含tmem41b的亚域密切相关,并且这两种结构都在吞噬体、ld和线粒体附近被发现。这些发现证明了ATG9A对体内细胞内脂质运输的需求,并表明吞噬分子组装位点有助于脂质从LDS分布到扩大的吞噬分子和线粒体。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。




