“优化版”赫赛汀!Fc优化免疫增强抗体margetuximab在美国申请上市,再鼎医药引入中国开发!
来源:本站原创 2019-12-20 19:32
2019年12月21日讯 /生物谷BIOON/ --MacroGenics是一家临床阶段的生物制药公司,专注于发现和开发用于治疗癌症的创新性单克隆抗体疗法。近日,该公司宣布,已向美国食品和药物管理局(FDA)提交了一份生物制品许可申请(BLA),寻求批准margetuximab联合化疗方案,用于转移性HER2阳性乳腺癌患者的治疗。margetuximab是采
2019年12月21日讯 /生物谷BIOON/ --MacroGenics是一家临床阶段的生物制药公司,专注于发现和开发用于治疗癌症的创新性单克隆抗体疗法。近日,该公司宣布,已向美国食品和药物管理局(FDA)提交了一份生物制品许可申请(BLA),寻求批准margetuximab联合化疗方案,用于转移性HER2阳性乳腺癌患者的治疗。
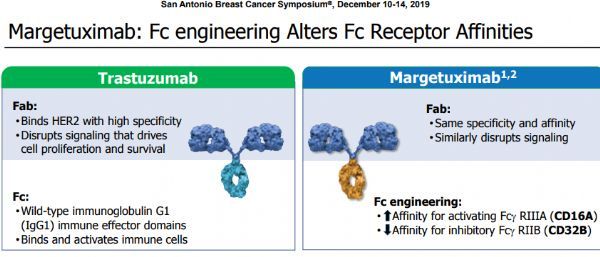
margetuximab是采用MacroGenics公司专有Fc优化技术平台开发的一种新型Fc结构域优化的免疫增强单克隆抗体,靶向HER2蛋白。此次BLA提交,基于关键性III期SOPHIA研究(NCT02492711)的安全性和疗效结果。该研究结果首次在2019年美国临床肿瘤学会(ASCO)年会上公布,最新数据于12月上旬在2019年圣安东尼奥乳腺癌研讨会(SABCS)上公布(点击查看)。
MacroGenics总裁兼首席执行官Scott Koenig博士表示:“作为公司的首次BLA提交,这标志着MacroGenics的一个重要里程碑。我们感谢参与这项研究的患者及其家人、以及所有参与开发margetuximab的人士。我们期待着与FDA密切合作,将margetuximab带给合适的患者。我们相信,SOPHIA研究的阳性结果证实了margetuximab在治疗这种破坏性疾病患者中的潜力。”
SOPHIA是一项头对头、随机、开放标签研究,正在评估margetuximab+化疗相对于曲妥珠单抗+化疗治疗HER2阳性转移性乳腺癌患者的疗效和安全性。入组研究的患者必须在转移性疾病治疗中接受过至少2种HER2靶向疗法,或接受过帕妥珠单抗(新)辅助治疗和至少一种HER2靶向疗法治疗转移性疾病,转移性疾病中总的疗法不超过3种疗法。该研究共入组了536例患者,这些患者之前均已接受过Herceptin(赫赛汀,曲妥珠单抗)和Perjeta(perturbation,帕妥珠单抗)治疗,约90%患者还接受过Kadcyla(ado-曲妥珠单抗 emtansine)治疗。研究中,这些患者以1:1比例被随机分配进入2个治疗组,接受每3周一次静脉输注15mg/kg剂量margetuximab(n=266)或每3周一次静脉输注6mg/kg(或8mg/kg的负荷剂量)曲妥珠单抗(n=270),同时接受4种化疗药物中的一种(卡培他滨、艾立布林、吉西他滨、长春瑞滨,剂量按标准剂量)治疗。
今年5月公布的结果显示,研究达到无进展生存期(PFS)主要终点:与曲妥珠单抗+化疗组相比,margetuximab+化疗组疾病进展或死亡风险显著降低24%(中位PFS:5.8个月 vs 4.9个月;HR=0.76;95%CI:0.59-0.98;p=0.033)。该研究入组的患者中,约85%携带CD16A(FcγRIIIa)158F等位基因,该等位基因与曲妥珠单抗和其他抗体疗法的临床反应降低相关。在这一预先指定的探索性亚组中,与曲妥珠单抗+化疗组相比,margetuximab+化疗组疾病进展或死亡风险降低32%(中位PFS:6.9个月 vs 5.1个月;HR=0.68;95%CI:0.52-0.90;p=0.005)。次要终点总缓解率(ORR),margetuximab+化疗组为22%(95%CI:17.3-27.7%),曲妥珠单抗+化疗组为16%(95%CI:11.8-21.0%)。
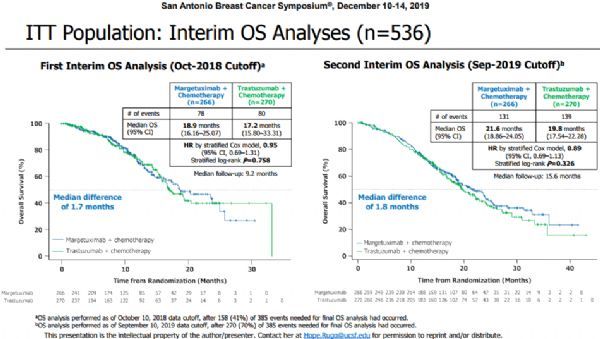
SABCS会上公布的第二次中期OS分析是截止2019年9月发生了270个事件后开展的。在意向性治疗(ITT)群体中,与曲妥珠单抗+化疗组相比,margetuximab+化疗组中位OS延长了1.8个月(21.6个月 vs 19.8个月,HR=0.885;95%CI:0.693-1.130,p=0.326)。最终的预先指定OS分析计划在累计385个事件后进行,预计在2020年开展。该研究的一项预先指定的探索性目标是评估CD16A等位基因变异对margetuximab活性的影响,结果显示在携带CD16A 158F等位基因的患者中,与曲妥珠单抗+化疗组相比,margetuximab+化疗组中位OS延长了4.3个月(23.7个月 vs 19.4个月,HR=0.793;95%CI:0.607-1.035,p=0.087)。在CD16A 158V等位基因纯合的约15%患者中,曲妥珠单抗组表现优于margetuximab组。
一项最新的调查员评估分析显示,截止2019年9月发生430个PFS事件后,PFS结果与之前一致(中位PFS:margetuximab治疗组为5.7个月 vs 曲妥珠单抗组为4.4个月,HR=0.71,名义p=0.0006)。同样,在本次更新分析时,ITT人群中有额外的患者可评估缓解。调查员评估的客观缓解率(ORR):margetuximab治疗组为25.2%(95%CI:20.1,30.9),曲妥珠单抗治疗组为13.7%(95%CI:9.8,18.4)(名义p=0.0006)。临床受益率(CBR:包括完全缓解[CR]+部分缓解[PR]+疾病稳定[SD]>6个月),margetuximab治疗组为48.1%(95%CI:42.0-54.3%),曲妥珠单抗组为35.6%(95%CI:27.9-41.6%)(名义p=0.0025)。
研究中,margetuximab+化疗的安全性与曲妥珠单抗+化疗具有可比性,并与先前报道的数据一致。margetuximab治疗组有145例(55%)患者出现≥3级不良事件,曲妥珠单抗组为140例(53%)。margetuximab组有45例(17%)患者出现严重不良反应,曲妥珠单抗组为50例(19%)。margetuximab组与曲妥珠单抗组相比输注相关反应更为常见(13% vs 3%),大多是1或2级,并与首次给药相关。
人表皮生长因子受体2(HER2)是一种存在于某些癌细胞表面的蛋白质,能促进肿瘤生长,并与侵袭性疾病和预后不良有关。大约15-20%的乳腺癌病例是HER2阳性。以HER2为靶点的单克隆抗体(mAb)大大改善了HER2阳性乳腺癌患者的预后,目前已成为早期和晚期乳腺癌的标准治疗方法。然而,对于接受这些药物治疗病情进展的转移性乳腺癌患者而言,目前还没有批准的HER2靶向疗法。对于复发性或难治性患者,推荐使用持续的HER2阻断,但在三线和超出三线治疗之外还没有批准的治疗方法,在使用曲妥珠单抗、帕妥珠单抗和ado-trastuzumab memtansine(T-DM1)疾病进展后也没有制定标准护理。
margetuximab是一种可靶向阻断HER2的Fc优化单抗,具有与曲妥珠单抗相似的HER2结合和抗增殖作用,同时其工程化的Fc结构域能够增强免疫系统的参与。
除了探索margetuximab在乳腺癌中的潜力之外,MacroGenics公司也正在与默沙东合作,将margetuximab与PD-1肿瘤免疫疗法Keytruda联合用药,通过同时调动先天免疫和适应性免疫治疗HER2阳性胃食管癌患者,注册II/III期临床已于最近启动患者入组。
值得一提的是,2018年11月底,再鼎医药(ZLAB)与MacroGenics达成战略合作,获得了3款免疫肿瘤学产品在中国大陆、香港、澳门和台湾地区的开发和商业化独家授权,其中就包括margetuximab。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->