科学家们在类器官研究领域取得的新成果!
来源:生物谷原创 2024-05-30 10:47
科学家有望利用类器官模型识别并开发新型潜在的胰腺癌疗法、首个3D打印的功能性人类大脑组织、首次利用人类胎儿脑组织培育出了大脑类器官
本文中,小编整理了多篇重要研究成果,共同解读科学家们近期在类器官研究领域取得的新进展和新成果,分享给大家!
【1】Cell Stem Cell:科学家有望利用类器官模型识别并开发新型潜在的胰腺癌疗法
doi:10.1016/j.stem.2023.11.011
KRAS突变(主要是G12D和G12V),主要存在于90%以上的胰腺导管腺癌(PDAC)病例中,近日,一篇发表在国际杂志Cell Stem Cell上题为“A pancreatic cancer organoid platform identifies an inhibitor specific to mutant KRAS”的研究报告中,来自Weill Cornell医学院等机构的科学家们通过研究开发了一种新型的药物筛选系统,其能利用类器官来模拟癌症,这或许有助于揭开未来开发胰腺癌疗法的潜在靶点。

科学家有望利用类器官模型识别并开发新型潜在的胰腺癌疗法
图片来源:Cell Stem Cell (2023). DOI:10.1016/j.stem.2023.11.011
这项研究中,研究人员在胰腺肿瘤类器官中测试了6000多种化合物,这些肿瘤类器官包含了常见的胰腺癌驱动突变,随后他们识别出了一种名为马来酸哌克昔林(perhexiline maleate)的心脏病药物或能有效抑制类器官的生长;研究者发现,类器官中驱动癌症的突变会迫使机体胆固醇水平异常大量产生,而这种药物在很大程度上会逆转这一趋势。研究者Todd Evans博士说道,我们识别出了过度活跃的胆固醇合成或能作为大多数胰腺癌中可被靶向作用的易感点。此外,这项研究还强调了利用遗传学定义的类器官来模拟癌症和发现新型疗法策略的价值。
如今,类器官已经成为科学家们研究健康和疾病状态下机体组织功能的流行工具,其能优人类或动物组织组成,同时也能创建一个器官的复杂架构,且能通过基因工程进行精确建模;类器官能模拟携带驱动癌症基因突变的特殊肿瘤类型,实际上,当这些肿瘤类器官来源于人类组织时,其就能比任何动物模型都有潜能更好地模拟人类癌症。这项研究中,研究人员建立了一种基于类器官的自动化药物筛选系统,其能用于研究常见的胰腺癌(胰腺导管腺癌,PDAC)和其它致死性人类癌症,这种由正常小鼠胰腺组织制造的类器官能被工程化修饰含有已知能驱动人类胰腺肿瘤的多种突变,所有类器官都包含KrasG12D,这是在大多数PDAC病例中发现的一种驱动癌症的突变基因的小鼠版本。
【2】Cell Stem Cell:重磅!科学家开发出首个3D打印的功能性人类大脑组织!
doi:10.1016/j.stem.2023.12.009
由于缺乏可靠的人类神经组织来适应神经回路的动态功能评估,目前科学家们在探测人类神经网络是如何运行的仍然受到了一定的阻碍;近日,一篇发表在国际杂志Cell Stem Cell上题为“3D bioprinting of human neural tissues with functional connectivity”的研究报告中,来自威斯康星大学麦迪逊分校等机构的科学家们通过研究开发出了首个3D打印的脑组织,其或能像典型的大脑组织一样生长和发挥功能;这一成就具有非常重要的意义,其能帮助科学家们深入研究人类大脑并开发治疗一系列神经和神经发育障碍等疾病的新型疗法,比如阿尔兹海默病和帕金森疾病等。
研究者Su-Chun Zhang说道,这或许是一种强大的模型,其能帮助我们理解人类机体中脑细胞和部分大脑之间是如何交流的,同时也可能改变我们对干细胞生物学、神经科学以及很多神经和精神疾病发病机制的看法。据研究者介绍,打印方法限制了此前打印脑组织的成功。这项研究中,研究人员并没有利用传统的3D打印方法—垂直堆叠(stacking layers vertically),而是利用了水平堆叠的方式,他们将从诱导多能干细胞培养出来的神经元置于一种此前尝试使用的更加柔软的“生物墨水”凝胶中;这些组织仍然具有足够的结构能连接在一起,但其又足够柔软能促使神经元彼此生长且开始彼此交流,这些细胞能挨个排列,就好像桌子上的铅笔挨个排列一样。
研究者表示,这些组织能保持相对较薄的程度,这就使得神经元能更容易从生长介质中获取足够的氧气和营养物质;那么结果就不言而喻了,也就是说,细胞之间能相互交流,打印的细胞能通过介质在每个打印层和不同结构层之间形成连接,形成与人类大脑相当的网络。神经元能通过神经递质进行交流、发送信号,彼此之间相互作用,甚至与添加到打印组织中的支持细胞形成适当的网络。如今研究人员打印了大脑皮层和纹状体,这一研究结果让研究人员非常震惊,即使他们打印了属于大脑不同部位的不同细胞,其仍然能以一种非常特殊和特定的方式进行交流。这种打印技术提供了对细胞类型和排列的精准控制,而这在大脑类器官中是找不到的,类器官的生长往往缺乏一定的组织和控制。
doi:10.1016/j.cell.2023.12.012
科学家们利用人类胎儿脑组织开发出可在体外自我组装的三维微型器官。这些在实验室培育的类器官为研究大脑如何发育开辟了一条全新的途径。它们还为研究与大脑发育有关的疾病(包括脑肿瘤)的产生和治疗提供了宝贵的手段。科学家们在实验室中使用不同的方法来构建模拟健康组织和疾病的生物学模型。这些方法包括细胞系、实验动物以及近年来出现的三维微型器官。这些所谓的类器官具有一定的特征和复杂程度,使得人们能够在实验室中密切模拟器官的功能。
类器官可以直接由组织细胞形成。人们还可以“引导”在胚胎或某些成体组织中发现的干细胞发育成他们要研究的器官。在此之前,大脑类器官是通过诱导胚胎干细胞或多能性干细胞生长成代表大脑不同区域的结构,从而在实验室中培育出来的。他们使用特定的分子混合物,试图模拟大脑的自然发育---这种分子混合物的“配方”都需要大量的研究才能开发出来。
近日,一篇发表在国际杂志Cell上题为“Human fetal brain self-organizes into long-term expanding organoids”的研究报告中,来自荷兰马克西马公主儿科肿瘤中心等机构的科学家们通过研究直接利用人类胎儿脑组织培育出了大脑类器官。
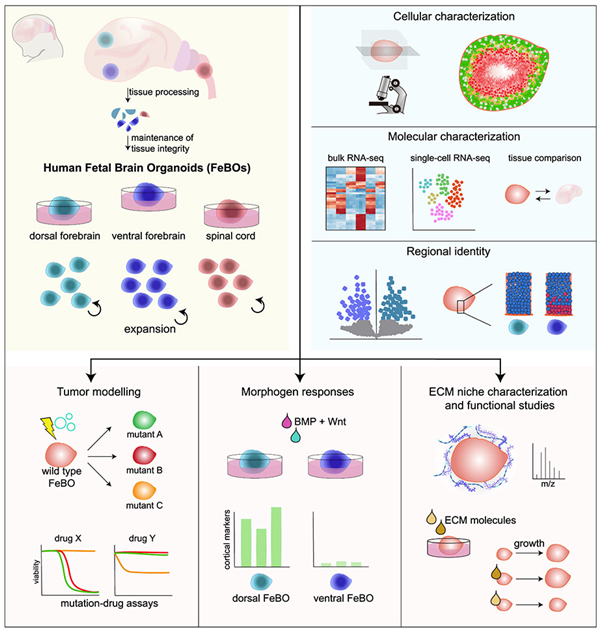
图片来源:Cell, 2024, doi:10.1016/j.cell.2023.12.012
文章中,研究者发现,使用小块胎儿脑组织而不是单个细胞对培育微型大脑至关重要。要培育出肠道等其他微型器官,科学家们通常会将原始组织分解成单个细胞。不过,在使用小块胎儿脑组织时,这些作者发现这些小块胎儿脑组织可以自组装成大脑类器官。这些大脑类器官的大小与米粒差不多。它们具有复杂的三维结构,包含多种不同类型的脑细胞。重要的是,这些大脑类器官中含有许多所谓的外侧放射状胶质细胞(outer radial glia)---一种在人类和我们的进化祖先中发现的细胞类型。这凸显了这些大脑类器官与人类大脑的密切相似性以及在研究中的用途。
【4】Nature:新型“迷你结肠”类器官 或能在时空分辨率下研究癌症的发生
doi:10.1038/s41586-024-07330-2
近日,一篇发表在国际杂志Nature上题为“Spatiotemporally resolved colorectal oncogenesis in mini-colons ex vivo”的研究报告中,来自洛桑联邦理工学院等机构的科学家们通过研究开发了一种能够真实再现结直肠癌发生的类器官模型—迷你结肠(mini-colon)。这些类器官能够长时间培养且可在单细胞分辨率下进行数周的实时追踪,或能用于研究与肿瘤生长有关的复杂过程,有望推动癌症治疗手段的开发。
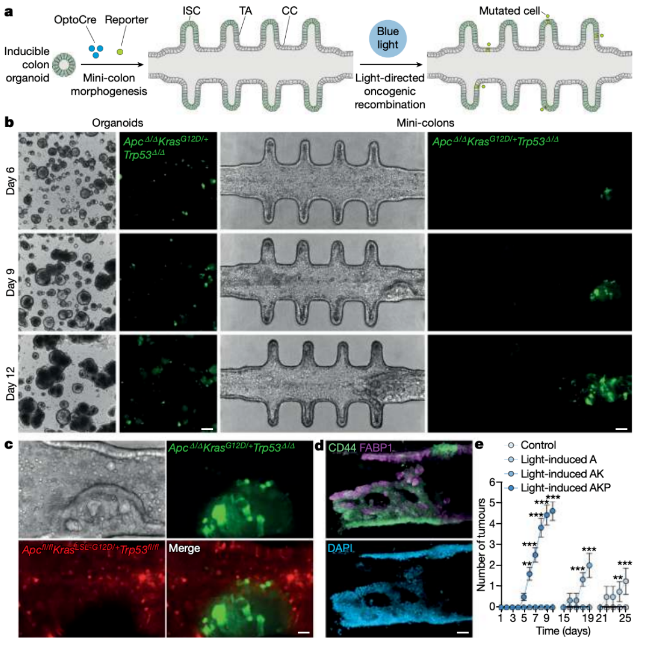
时空调节的微型结肠的从头肿瘤发生
图片来源:Nature,doi:10.1038/s41586-024-07330-2
在这项研究中,研究团队开发了拓扑生物学复杂的微型结肠(mini-colon),通过集成微制造技术、光遗传学和组织工程方法,能够在体外完成结直肠肿瘤发生过程。这些类器官具有以下特点:1)培养时间较长,在数周时间里无需传代破坏培养;2)以稳定和解剖相关的拓扑结构再现干细胞分化的细胞模式轴;3)易于突变和时空控制追踪;4)创建了一个生物力学动态系统,允许肿瘤出现的同时保留周围健康组织的完整性。这些特征允许生物复杂性肿瘤的体外发生,并提供了一种高分辨率系统,可用于分析协调癌症起始的分子因素,从而弥合了体外和体内模型之间的差距。
这些类器官在蓝光照射下指导癌基因激活,在预先确定的位置发展出癌性肿瘤,研究团队随后可在不破坏培养的情况下对这些肿瘤进行数周的单细胞分辨率的实时追踪。这些癌细胞被证明和取自小鼠的细胞能以相同效率和病理变化发展出肿瘤,提示它们是动物结直肠癌发生的代表性模型。研究团队推断,这些模型将帮助开发和发现基因靶标和肿瘤抑制药物,比当前的细胞培养物更能完整再现癌症进展。
【5】Nature子刊:利用人类干细胞培育出胶质母细胞瘤样类器官
doi:10.1038/s41698-024-00500-5
近日,一篇发表在国际杂志npj Precision Oncology上题为“A multidimensional atlas of human glioblastoma-like organoids reveals highly coordinated molecular networks and effective drugs”的研究报告中,来自德国癌症研究中心等机构的科学家们通过研究在实验室中利用人类干细胞培育出胶质母细胞瘤样类器官(glioblastoma-like organoids, GLO),其是研究胶质母细胞瘤中的基因突变与分子亚型之间相关性的合适模型。在研究GLO时,他们发现胶质母细胞瘤的发展以脂质代谢的重编程为特征,这可能是开发新药的起点。
胶质母细胞瘤是所有脑肿瘤中恶性程度最高、最危险的一种。大量研究已表明胶质母细胞瘤细胞具有极大的异质性。然而,迄今为止,广泛的分子知识对改善该疾病的治疗却贡献甚微。为了开发有效的靶向疗法,科学家们必须首先准确了解癌细胞中存在哪些基因突变,以及这些基因突变对细胞信号通路有什么影响。此类研究需要能用于模拟这一过程并测试可能的候选药物的模型。常用的 PDX 模型是将患者特异性肿瘤细胞转移到小鼠体内,但这种模型不太适合研究单个突变的影响,因为它们有非常不同的遗传背景。这同样适用于由患者细胞培养而成的经典肿瘤类器官。
在这项新的研究中,这些作者设计出了一种解决方案:他们使用由人类诱导性多能干细胞(iPSC)培育而成的类器官模型。他们称之为胶质母细胞瘤样类器官(GLO)。为了模拟胶质母细胞瘤的特性,他们使用CRISPR-Cas基因剪刀精确地关闭了iPSC中通常在胶质母细胞瘤患者中丢失的肿瘤抑制基因。他们能够生成一组完全类似于胶质母细胞瘤患者中存在的主要突变谱的GLO。
【6】Int J Biol Sci:新研究成功培育出小鼠睾丸类器官,有望推进男性不育研究
doi:10.7150/ijbs.89480
睾丸负责制造精子和合成睾酮。睾丸发育和功能异常会导致性发育障碍(DSD)和男性不育。目前,还没有用于模拟睾丸的体外系统。
近日,一篇发表在国际杂志International Journal of Biological Sciences上题为“Towards a ‘Testis in a Dish’: Generation of Mouse Testicular Organoids that Recapitulate Testis Structure and Expression Profiles”的研究报告中,来自以色列巴伊兰大学等机构的科学家们通过研究成功制造出了“实验室睾丸(laboratory testicles)”,这可能会大大促进人们对性别决定机制的了解,并为男性不育症提供解决方案。
文章中,研究人员所制造的这种人造睾丸是睾丸类器官(testis organoids)——一种利用真正的小鼠睾丸制造出来的微型人造器官。在过去十年中,随着人们认识到体外二维细胞样本无法模拟整个器官的行为,类器官的发展取得了巨大进步。如今,大脑、肾脏、肠道和其他器官的类器官已经被制造出来。Gonen团队制造的睾丸类器官能较完美地模拟天然睾丸。这种人造睾丸是从新生小鼠体内提取的未成熟睾丸细胞培养出来的。当Gonen团队发现管状结构和细胞组装与体内睾丸高度相似时,他们意识到这一过程取得了成功。这些管状结构与产生精子的天然睾丸中的多个曲细精管(seminiferous tubule)相似。
他们的睾丸类器官在体外成功培养了九周。这被认为是一段很长的时间,理论上足以完成精子生成和激素分泌的过程。在小鼠体内,这个过程需要34天,因此这种睾丸类器官相对较长的寿命可能会让这些过程在体外进行。
【7】npj Precis Onc:类器官研究或有望帮助开发治疗人类子宫内膜癌的新型潜在疗法
doi:10.1038/s41698-023-00478-6
转移性/复发性子宫内膜癌(EC,endometrial cancer)患者的治疗选择非常有限,其疗法预后往往较差,最近研究人员发现FGFR2c剪接异构体(splice isoform)或与子宫内膜癌患者预后不良直接相关。近日,一篇发表在国际杂志npj Precision Oncology上题为“Endometrial cancer PDX-derived organoids (PDXOs) and PDXs with FGFR2c isoform expression are sensitive to FGFR inhibition”的研究报告中,来自昆士兰大学等机构的科学家们通过研究发现了一种治疗人类子宫内膜癌非常有前景的疗法。
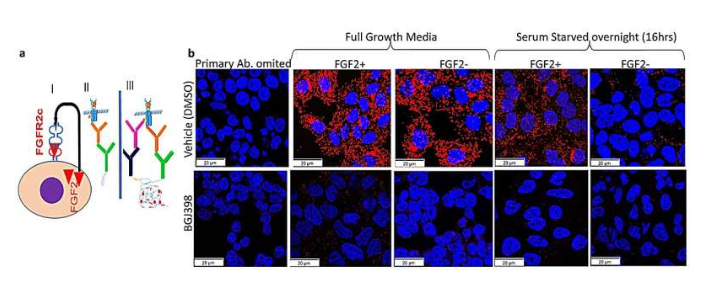
类器官研究或有望帮助开发治疗人类子宫内膜癌的新型潜在疗法
图片来源:npj Precision Oncology (2023). DOI:10.1038/s41698-023-00478-6
研究者表示,如果在初次治疗后癌症发生扩散或复发的话,子宫内膜癌患者的预后往往较差,而这常常影响着15%-20%的患者的健康;子宫内膜癌PDX衍生类器官(PDXOs)和携带FGFR2c异构体表达的PDXs对于FGFR抑制敏感,这或许就促使研究人员需要后期对患者进行相关试验来证实。
子宫内膜癌能通过手术治愈,但如果其已经扩散到了腹腔和机体其它器官的话,患者的治疗选择就非常有限了。此前研究人员发现,携带成纤维细胞生长因子受体2c(FGFR2c)的子宫内膜癌女性往往生存率较低;于是,在这项研究中,研究人员开发了一种特殊的类器官进行研究,即在水凝胶中从患者子宫内膜癌细胞生长出来的三维微型肿瘤,其或许就能帮助研究肿瘤结构和遗传学的复杂性。研究者发现,携带激活FGFR2c的子宫内膜癌类器官或能被FGFR抑制药物所阻断,而且类器官的生长也会被破坏并发生死亡。
【8】Cell子刊:中国科学家开发出用于酒精性肝病研究的人肝脏类器官
doi:10.1016/j.crmeth.2024.100778
近日,一篇发表在国际杂志Cell Reports Methods上题为“Modeling alcohol-associated liver disease in humans using adipose stromal or stem cell-derived organoids 的研究报告中,来自首都医科大学等机构的科学家们通过研究开发了基于人脂肪基质细胞/干细胞(hASC)的肝脏类器官,并在体外使用酒精(乙醇)处理以模拟人类酒精性肝病(ALD),这些类器官为探索ALD的机制和肝脏代谢功能障碍患者的个性化治疗,提供了一种新的疾病模型。
虽然酒精性肝病(ALD)的病因和基本病理过程已经很清楚,但由于缺乏合适的、可靠的人类疾病模型,这极大地限制了治疗药物的开发。最近,有研究利用人多能干细胞(hPSC)的上皮和间质谱系的协同分化,成功地培育出了多细胞的人类肝脏类器官模型。该模型再加上游离脂肪酸治疗,重现了脂肪性肝炎样病理(包括脂肪变性、炎症和纤维化)的进行性、阶段性发展,并且有可能通过类器官硬度分析用于药物筛选。
对肝病状态(例如脂肪性肝炎)的易感性差异很大。例如,并非所有肥胖者都会出现脂肪变性,大多数脂肪变性病例也不会发展为脂肪性肝炎。因此,需要体外个性化肝组织模型系统来进行疾病建模、药物发现和药物毒性研究。此前,研究人员开发出了一种可重复的三阶段方法,可以直接将人脂肪基质细胞/干细胞(hASC)分化为功能性肝细胞。
【9】Cell Rep:利用在培养皿中培育的类器官或能识别出驱动肿瘤生长的特殊基因
doi:10.1016/j.celrep.2023.113355
体细胞拷贝数增加在多种癌症类型中普遍存在,然而其在致癌发生过程中所发挥的作用目前研究人员尚未充分评估过,这部分是由于复制增益会跨越较大的染色体区域,从而就会模糊因果位点。近日,一篇发表在国际杂志Cell Reports上题为“Functional screening of amplification outlier oncogenes in organoid models of early tumorigenesis”的研究报告中,来自斯坦福大学医学院等机构的科学家们通过研究发现了一种新方法来筛选引起多种不同类型癌症生长的基因,并识别出了在口腔癌和食管鳞状癌中非常有希望的潜在靶点。
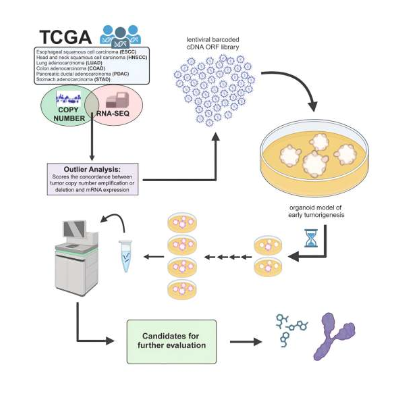
利用在培养皿中培育的类器官或能识别出驱动肿瘤生长的特殊基因
图片来源:Cell Reports (2023). DOI:10.1016/j.celrep.2023.113355
文章中,研究人员利用称之为类器官的三维器官组织模型,从癌症基因组图谱中识别并测试潜在的基因靶点。研究者Ameen Salahudeen博士解释道,癌症基因组图谱中有大量的数据,这一领域目前已经开发出了能延长患者寿命的精准药物,但这些数据中仅有一小部分能告诉我们癌症是如何生长的以及是否其能作为新型药物靶点;我们需要一种可扩展的功能性方法来从驱动癌症生长的原因以及是否其能被靶向作用方面对数据进一步深入分析。
为了能阐明引起肿瘤生长的基因,研究人员决定重点关注能展示两种情况的基因组区域,即具有相同基因异常高拷贝的基因组区域,这在许多癌症类型中都非常常见;以及具有较高RNA表达水平的基因组区域,这或许表明这些基因参与到了肿瘤的生长过程中,为此研究人员利用了其所开发的新型算法来进一步研究。随后研究人员在基因组中确定了6种不同癌症类型的潜在区域,包括食管癌、口腔癌、结肠癌、胃癌、胰腺癌和肺癌;下一步他们为这6个器官构建了特定的肿瘤类器官,并在类器官中测试了其候选基因来观察哪些基因与生长中的肿瘤有关。
【10】Nature子刊:具备免疫系统的类器官可评估肿瘤免疫治疗脱靶效应
doi:10.1038/s41551-023-01156-5
通过招募免疫细胞靶向肿瘤,癌症免疫治疗已成为目前对抗癌症最有前途的策略之一。尽管显示出良好的临床疗效,但由于癌症细胞和免疫抑制肿瘤环境中新抗原的低表达等因素影响,肿瘤免疫疗法只对一小部分患者和肿瘤亚群有效。此外,免疫毒性也是抗癌免疫药物临床应用的主要障碍。几乎所有靶向T细胞的药物,如免疫检查点抑制剂、CAR T细胞和T细胞双特异性抗体(T-cell-engaging bispecific antibodies, TCBs)等,都会在健康组织引起严重的不良反应,限制免疫疗法的广泛应用。然而,这些免疫治疗的问题通常是传统临床前毒理学模型无法预见的。无论是细胞还是动物,传统的疾病模型一方面不能捕捉到天然器官的复杂性,一方面缺乏人类特异性组织特征和免疫反应。
近日,一篇发表在国际杂志Nature Biomedical Engineering上题为“Analysis of off-tumour toxicities of T-cell-engaging bispecific antibodies via donor-matched intestinal organoids and tumouroids”的研究报告中,来自罗氏公司、巴黎萨克雷大学和巴塞尔大学的研究人员通过合作研究发现了具备免疫系统的患者来源肠道类器官和肿瘤类器官,可用于研究T细胞双特异性抗体的肿瘤免疫治疗脱靶效应,并获得传统疾病模型无法预测的临床毒性和患者间药物反应差异性。
研究团队利用手术切除的小肠和结直肠组织培养肠道类器官,评估了TCB的两个靶蛋白CEA(carcino-embryonic antigen)和EpCAM(epithelial cell-adhesion molecule)在类器官中的表达,并将其与亲代肠道样本的表达情况进行了比较。组织学评估显示,EpCAM和CEA均存在于健康的肠道组织中。而两种靶蛋白在对应的类器官中,以体内相似的形态学模式表达:EpCAM定位于细胞连接中,而CEA显示出顶端(apical)定位。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


