新型抗炎药!礼来IL-23p19抑制剂mirikizumab治疗溃疡性结肠炎(UC)3期临床疗效显著!
来源:本站原创 2022-02-20 03:23
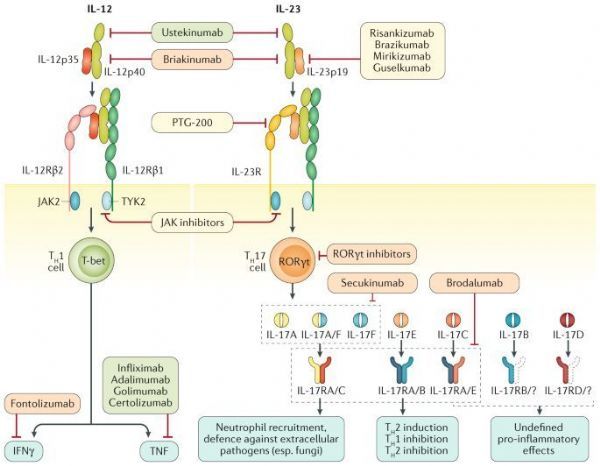
mirikizumab是一种人源化IgG4单抗,靶向结合IL-23的p19亚基,开发用于治疗多种免疫性疾病。
炎症性肠病(UC,CD,图片来源:tahminahaqmd.com)
2022年02月19日讯 /生物谷BIOON/ --礼来(Eli Lilly)近日在2022年第17届欧洲克罗恩病和结肠炎组织(ECCO)大会上首次公布了新型抗炎药mirikizumab治疗中重度溃疡性结肠炎(UC)3期临床项目的数据。这些数据来自关键3期LUCENT-1研究(NCT03518086)。这是一项为期12周的安慰剂对照诱导3期研究,在接受常规和/或生物疗法和/或JAK抑制剂治疗失败的中重度UC患者中开展,评估了mirikizumab的疗效和安全性。
会上公布的结果显示,主要终点方面:在治疗第12周,与安慰剂组相比,mirikizumab治疗组的临床缓解率在统计学上更高(p=0.00006),当结肠炎症得到控制或缓解,导致大便次数和出血等症状正常化或接近正常化时,即可达到临床缓解。此外,该研究也达到了全部关键次要终点:与安慰剂组相比,mirikizumab治疗组在临床、症状、内镜、组织学(组织细胞水平)指标方面也取得了统计学上的显著改善,包括排便急迫性、临床反应、内镜缓解、症状缓解和内镜组织炎症的改善,具有高度统计学意义的p值。此外,mirikizumab在开始治疗4周后就显示出患者症状的快速改善。mirikizumab还可以减轻先前对生物和/或Janus激酶(JAK)抑制剂治疗无反应或停止反应的患者的症状。
UC是一种大肠(又称结肠)的慢性炎症性疾病,它影响结肠衬里,并可能导致小疮或溃疡的形成。这种炎症可引起腹痛、频繁和紧急如厕、血便和尿失禁。UC可导致严重和使人衰弱的日常生活中断。在全球范围内,有数百万人患有UC。
mirikizumab是一种人源化IgG4单克隆抗体,靶向结合IL-23的p19亚基,该药目前正开发用于多种免疫性疾病,包括斑块型银屑病(PsO)、溃疡性结肠炎(UC)、克罗恩病(CD)等。UC和CD是2种炎症性肠病,可能引起严重和使人衰弱的症状,并干扰日常生活。
mirikizumab治疗UC的3期临床项目LUCENT共包括3项研究,分别为LUCENT-1、LUCENT-2(NCT03524092)、LUCENT-3(NCT03519945)。LUCENT-2是一项多中心、随机、双盲、安慰剂对照维持研究,入组的是已完成12周治疗的LUCENT-1诱导研究的患者。最后一项研究在已参与了mirikizumab治疗UC临床试验的患者中开展。
目前仍然需要额外的治疗方法,使UC患者从最具挑战性的症状中解脱出来。根据LUCENT项目的数据,礼来计划在2022年上半年,首先向美国食品和药物管理局(FDA)提交mirikizumab治疗UC的上市申请,之后向全球其他监管机构提交。mirikizumab有潜力为治疗UC带来第一个抗IL-23p19生物制剂。
炎症性肠病:治疗靶点(图片来源于文献PMID30478416)
LUCENT-1研究共入组了1162例患者,包括先前没有接受过生物制剂(biologic-naive,生物制剂初治)治疗的患者,以及先前接受过一种生物制剂(biologic-experienced,生物制剂经治)但治疗失败的难治性患者。
结果显示:(1)治疗第12周,mirikizumab治疗组有24.2%(n=210/868)、安慰剂组有13.3%(n=39/294)的患者达到了临床缓解(p=0.00006),表明症状缓解改善和炎症消除或接近消除。(2)治疗第12周,mirikizumab治疗组有63.5%(n=551/868)、安慰剂组有42.2%(n=124/294)的患者达到临床反应(p<0.00001)。
治疗第12周,mirikizumab治疗组有45.5%(n=395/868)、安慰剂组有27.9%(n=82/294)的患者达到症状缓解(p<0.001)。早在治疗4周内,mirikizumab治疗组有21.8%(n=189/868)、安慰剂组有12.9%(n=38/294)的患者实现症状迅速改善(p<0.001)。
早在治疗2周内并持续至第12周,mirikizumab治疗组患者在11分肠道急症严重程度评分上有统计学意义的显著降低。在12周时,mirikizumab治疗组患者的得分平均下降2.59分(2.32到2.85),而安慰剂组患者的平均得分下降1.63(1.18到2.09)(p<0.00001)。2周肠道急迫终点是预先指定的,但不是多样性控制的(multiplicity-controlled)。
该研究中,mirikizumab的总体安全性与之前在UC中的研究相似,并与其他治疗领域的其他抗IL-23p19抗体一致。与安慰剂组相比,mirikizumab治疗组报告的严重不良事件发生率较低(mirikizumab:2.8%,n=27;安慰剂:5.3%,n=17),且因不良事件中断研究的可能性较小(mirikizumab:1.6%,n=15;安慰剂:7.2%,n=23)。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->