神经干细胞研究进展(第6期)
来源:生物谷原创 2023-12-31 19:23
神经干细胞(neural stem cell)是指存在于神经系统中,具有分化为神经神经元、星形胶质细胞和少突胶质细胞的潜能,从而能够产生大量脑细胞组织,并能进行自我更新,并足以提供大量脑组织细胞的细胞
神经干细胞(neural stem cell)是指存在于神经系统中,具有分化为神经神经元、星形胶质细胞和少突胶质细胞的潜能,从而能够产生大量脑细胞组织,并能进行自我更新,并足以提供大量脑组织细胞的细胞群。需要注意的是,在脑脊髓等所有神经组织中,不同的神经干细胞类型产生的子代细胞种类不同,分布也不同。 神经干细胞的治疗机理是:(i)患病部位组织损伤后释放各种趋化因子,可以吸引神经干细胞聚集到损伤部位,并在局部微环境的作用下分化为不同种类的细胞,修复及补充损伤的神经细胞。由于缺血、缺氧导致的血管内皮细胞、胶质细胞的损伤,使局部通透性增加,另外在多种黏附分子的作用下,神经干细胞可以透过血脑屏障,高浓度的聚集在损伤部位;(ii)神经干细胞可以分泌多种神经营养因子,促进损伤细胞的修复;(iii)神经干细胞可以增强神经突触之间的联系,建立新的神经环路。
神经干细胞应用中存在的问题:建立的神经干细胞系绝大多数来源于鼠,而鼠与人之间存在着明显的种属差异;神经干细胞的来源不足;部分移植的神经干细胞发展成脑瘤;神经干细胞转染范围的非选择性表达及转染基因表达的原位调节等等。
基于此,小编针对近年来神经干细胞研究取得的进展进行一番盘点,以飨读者。
1.Lancet Oncol:初步临床试验表明利用神经干细胞递送溶瘤病毒有望治疗恶性胶质瘤
doi:10.1016/S1470-2045(21)00245-X
恶性胶质瘤是成人中最常见的原发性脑肿瘤,目前没有有效的治疗方案,平均生存期为14至21个月。胶质瘤细胞是出了名的耐药性和难治性,突出了对创新和有效疗法的关键需求,这些疗法应当比化疗和放疗等传统疗法的不良副作用更少。
在一项新的1期临床研究中,来自美国西北大学医学院的研究人员开发的一种新型疗法改善了新诊断的恶性胶质瘤患者的无进展生存期和总生存期。相关研究结果近期发表在Lancet Oncology期刊上,论文标题为“Neural stem cell delivery of an oncolytic adenovirus in newly diagnosed malignant glioma: a first-in-human, phase 1, dose-escalation trial”。
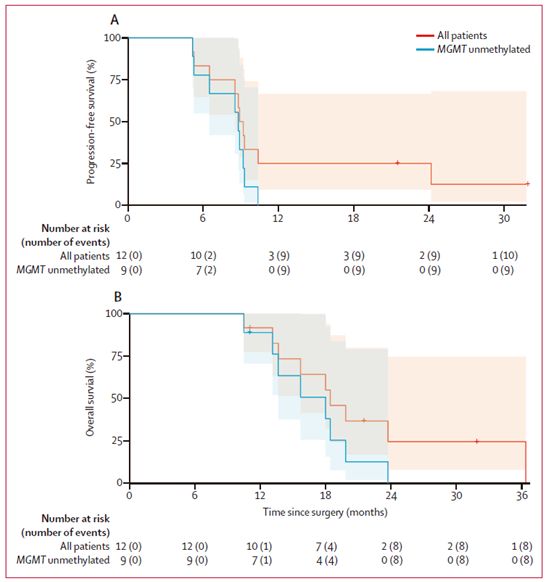
经过NSC-CRAd-S-pk7治疗的恶性胶质瘤患者的生存结果,图片来自The Lancet Oncology, 2021, doi:10.1016/S1470-2045(21)00245-X。
在这项研究中,这些作者评估了这种名为NSC-CRAd-S-pk7的新型疗法对新诊断的恶性胶质瘤患者的安全性。NSC-CRAd-S-pk7是一种由神经干细胞或中枢神经系统的祖细胞递送的溶瘤腺病毒,它能穿过血脑屏障向癌细胞传递治疗性分子。
为了确定NSC-CRAd-S-pk7的安全性,这些作者招募了新诊断的恶性胶质瘤患者,并将这些患者分为三个队列。在接受神经外科手术切除后,每个队列都接受了不同剂量的NSC-CRAd-S-pk7进入切除腔壁,然后在术后10至14天进行化疗和放疗。
随访检查显示,所有剂量的NSC-CRAd-S-pk7对患者都是安全和可耐受的,平均无进展生存期为9个月,总生存期为18个月。MGMT启动子未甲基化的胶质瘤患者也显示出无进展生存期和总生存期的改善,其中MGMT(6-甲基鸟嘌呤-DNA甲基转移酶)是会增加癌细胞对化疗抵抗力的DNA修复酶。
这些作者说,这些改善的结果是很重要的,因为新诊断的胶质母细胞瘤患者如果只接受放疗和化疗,其平均无进展生存期为7个月,总生存期为15个月。此外,这些研究结果支持在更高阶段的临床试验中继续调查NSC-CRAd-S-pk7的最高预设剂量。
2.Cell子刊:揭示fractalkine分子促进神经干细胞产生少突胶质细胞,有望治疗一系列神经系统疾病
doi:10.1016/j.stemcr.2021.06.010
在一项新的研究中,来自加拿大阿尔伯塔大学的研究人员发现一种名为fractalkine的免疫分子能够促进产生髓鞘的脑细胞的产生。相关研究结果近期发表在Stem Cell Reports期刊上,论文标题为“Fractalkine signaling regulates oligodendroglial cell genesis from SVZ precursor cells”。

图片来自Stem Cell Reports, 2021, doi:10.1016/j.stemcr.2021.06.010。
论文通讯作者、阿尔伯塔大学医学遗传学系助理教授Anastassia Voronova解释说,神经干细胞产生包括少突胶质细胞在内的多种脑细胞。作为中枢神经系统和周围神经系统的一种细胞,少突胶质细胞是唯一能产生髓鞘的脑细胞。
Voronova说,“在发育过程中,这些神经干细胞形成了大脑。在成体大脑中,它们存在的部分原因是为了补充受损或丢失的细胞,包括少突胶质细胞。然而,特别是在人类中,少突胶质细胞的替换是非常低效的。我的实验室的目标是确定能够‘唤醒’我们大脑中所有神经干细胞的分子,以补充这些少突胶质细胞。”
这项新的研究表明fractalkine---一种以前认为只有在免疫系统中才发挥作用的分子---明显刺激了神经干细胞转化少突胶质细胞。
3.Stem Cells子刊:神经干细胞可能是治疗新生儿大脑损伤的关键
doi:10.1002/sctm.21-0243
怀孕期间或出生前后的大脑损伤可能会对后代产生终身的影响,包括脑瘫和癫痫,但目前尚无治疗方法使受伤的新生儿大脑再生。神经干细胞(NSC)具有在大脑中定植和再生受损脑组织的潜力。在对这一领域的最广泛研究回顾中,NSC在减少新生儿大脑损伤方面具有很强的潜力。
NSC是大脑的组成部分。科学家们正在开展研究来确定如何可能利用NSC来促进大脑受伤部位的恢复。在近期发表在Stem Cells Translational Medicine期刊上的一篇标题为“Neural stem cell treatment for perinatal brain injury: A systematic review and meta-analysis of preclinical studies”的综述论文中,澳大利亚哈德逊医学研究所的Madelein Smith及其研究团队分析了所有已发表的临床前研究,发现NSC可以减少大脑损伤并改善大脑损伤后的身体功能。
具体而言,Smith团队使用MEDLINE和Embase对使用围产期脑损伤动物模型的NSC治疗进行了对照性干预研究。主要结果是脑梗塞大小、运动和认知功能。荟萃分析的数据被综合起来,并使用随机效应模型表示为标准化的平均差异(SMD)和95%的置信区间(CI)。他们还报告了次要结果,包括NSC的生存、迁移、分化和对神经炎症的影响。18项研究符合纳入标准。基于受损的前肢偏好测试(SMD 2.27; CI: 0.85, 3.69, P = .002; I2 = 86%)和转棒测试(SMD 1.88; CI: 0.09, 3.67, P = .04; I2 = 95%)测量,NSC的使用减少了梗死面积(SMD 1.09; CI: 0.44, 1.74, P = .001; I2 = 74%)改善了运动功能。此外,NSC改善了通过莫里斯水迷宫测试测量的认知功能(SMD为2.41;CI:1.16,3.66,P = .0002;I2 = 81%)。临床前证据表明,NSC疗法对治疗围产期大脑损伤很有前景。
4.PNAS:神经干细胞疗法联合药物图卡替尼或有望帮助改善脑转移乳腺癌患者的生存率
doi:10.1073/pnas.2112491119
脑转移是导致乳腺癌患者死亡的主要原因,缺乏临床试验以及血脑屏障的存在往往会限制乳腺癌患者的治疗;近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“Combination of tucatinib and neural stem cells secreting anti-HER2 antibody prolongs survival of mice with metastatic brain cancer”的研究报告中,来自美国西北大学等机构的科学家们通过研究将神经干细胞与HER2抑制剂药物图卡替尼(tucatinib)联合使用或能改善HER2阳性乳腺癌脑转移小鼠的生存。相关研究结果证实了利用工程化神经干细胞来进行脑部肿瘤药物运输的有效性,并有望帮助开发新型有效的治疗性手段来抵御HER2阳性乳腺癌患者的大脑转移。

研究者Alex Cordero-Casanovas博士表示,全身性的化疗制剂针对大脑的渗透性较低,因此我们就需要开发一种创新性的治疗性策略和运输平台来改善脑转移癌症患者的临床治疗结局。在当前研究中,研究人员就设计出了一种人类衍生的神经干细胞来持续产生大量抗体,从而抑制HER2的表达,同时还不影响这些干细胞的干性、迁移和肿瘤滋生特性。
当利用神经干细胞在体外治疗HER2阳性的乳腺癌细胞后,研究者发现,所分泌的抗HER2抗体或能通过抑制PI3K-Akt信号通路来阻断肿瘤细胞的增殖,这一通路对于肿瘤细胞生长和生存都非常必要。随后研究人员通过将肿瘤细胞注射到小鼠的颈动脉中开发了HER2阳性乳腺癌和脑转移模型,这或许就代表了人类患者疾病的多病灶特性,接下来研究人员给予小鼠注射神经干细胞对照、神经干细胞抗HER2的神经干细胞或安慰剂,并结合HER2抑制剂药物图卡替尼治疗,给予小鼠口服24天药物组合。
结果表明,接受抗HER2干细胞以及图卡替尼组合性疗法的小鼠相比对照细胞或安慰剂结合图卡替尼组合疗法的小鼠而言,其生存期发生了明显延长。研究者Cordero-Casanovas说道,神经干细胞和图卡替尼都能穿过机体的血脑屏障,因此其并不存在大脑渗透性的问题,如今研究人员证明了这种组合性疗法或能靶向作用大脑中的HER2阳性乳腺癌细胞并能增强HER2阳性乳腺癌脑转移临床相关模型的生存率。下一步研究人员非常感兴趣研究基于神经干细胞的组合性策略的治疗效率,从而帮助开发抵御HER2阳性乳腺癌脑转移患者的有效靶向性治疗策略。
doi:10.1016/j.cell.2023.02.017
在一项新的研究中,来自美国斯坦福大学的研究人员设计了一种荧光激活细胞分选方法,从人类大脑组织中分离出不同的神经干细胞和祖细胞类型。这项研究中使用的标志物在不同的大脑区域都是保守的。该技术应有助于未来的神经发育研究,并加速开发基于神经细胞移植的治疗方案,以治疗一系列神经系统疾病。相关研究结果发表在2023年3月16日的Cell期刊上,论文标题为“Purification and characterization of human neural stem and progenitor cells”。
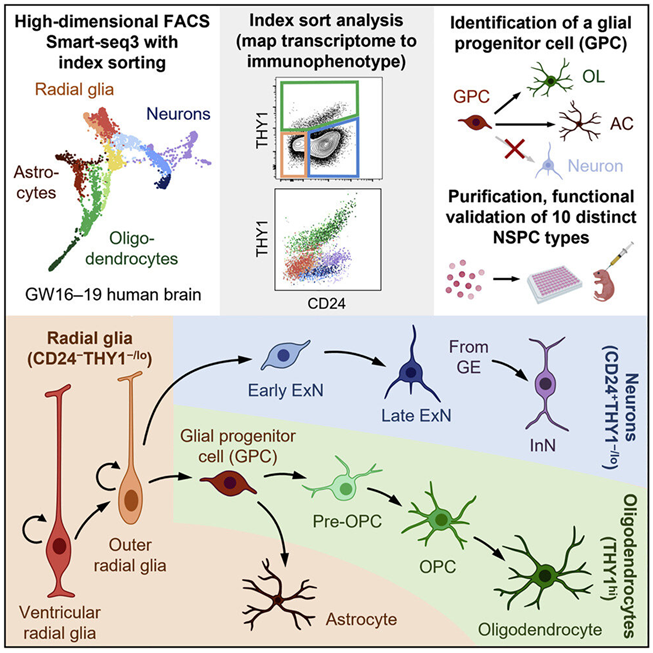
图片来自Cell, 2023, doi:10.1016/j.cell.2023.02.017。
荧光激活细胞分选用于从单细胞悬浮液中根据细胞表面免疫表型分离脑组织中的细胞类型。细胞经过索引(荧光记录)并相互分离。这些分离的细胞接受单细胞RNA测序,以捕获它们各自的转录组。通过将表面标志物谱与索引和转录组相结合,这些作者如今有了每个细胞类型的图谱,可用于以后的识别。他们还测量了最初分离方案中没有使用的另外352种表面标志物的表达,这些标志物可能在未来更好地区分细胞。
索引排序数据允许每种被测序的细胞对应到它们的原始免疫表型,而且这些作者发现RNA和细胞表面蛋白的表达并不总是相关的。一些看起来相似的细胞可能有不同的功能。这种策略产生了功能相似的分选细胞群体,从而允许分离出特定的神经干细胞和祖细胞类型来进行分析。
这些作者确定了10种神经干/祖细胞类型,并通过将它们直接移植到新生儿免疫缺陷小鼠的大脑中来确定这些细胞的行为特征。6个月后,这些细胞在整个大脑中广泛迁移和定植,并分化出所有三种主要的神经细胞谱系。通过观察单个细胞类型的扩散方式和位置,他们可以对适宜的活动位点做出一些初步推断。虽然该实验仅仅是作为一种方法的可行性测试,但是他们确实确定了一种以前没有描述过的独特的双能性胶质祖细胞(bipotent glial progenitor cell)的功能特征。
6.Inflamm Regen:揭示大脑中神经干细胞维持自身生境的特殊分子机制
doi:10.1186/s41232-022-00254-2
当提及细胞类型,干细胞就具有无限的潜力,这些能自我更新的细胞可以产生机体中的任何细胞类型,其“居住”在称之为生境(niche)的微环境中。近日,一篇发表在国际杂志Inflammation and Regeneration上题为“Organization of self-advantageous niche by neural stem/progenitor cells during development via autocrine VEGF-A under hypoxia”的研究报告中,来自东京医科大学等机构的科学家们通过研究揭示了大脑中神经干细胞生境的动态学变化,其是大脑中干细胞的“住所”。
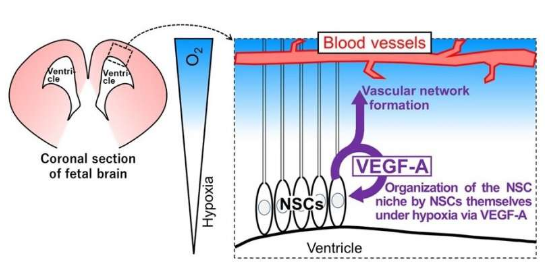
揭示大脑中神经干细胞维持自身生境的特殊分子机制。图片来源:Inflammation and Regeneration (2023). DOI:10.1186/s41232-022-00254-2
文章中,研究人员调查了缺氧状况在发育期间对大脑中神经干细胞生境的影响效应;神经干祖细胞(NPSCs,neural stem and progenitor cells)能产生大脑和神经系统中的细胞,其定居在缺氧的生境中,也就意味着其所居住的生境中的氧气水平低于周围组织的氧气水平,然而,关于生境的组成以及神经干祖细胞如何在生境中自我维持,研究人员并不清楚。
这项研究中,研究人员利用从胚胎小鼠的前脑中分离出的神经干祖细胞细胞培养模型来分析神经干细胞生境中低氧水平所产生的影响,他们将这些细胞培养成处于低氧和正常氧气水平下的神经球(neurospheres)或自由漂浮的干细胞簇。Taichi Kashiwagi博士说道,本文研究结果非常惊人,相比常氧条件下,在缺氧状况下我们能观察到神经球的形成会明显增加,这就促使我们深入研究在缺氧状况下到底是哪些因素在维持和促进神经干祖细胞增殖方面扮演着重要角色。
研究人员评估了一种名为血管内皮生长因子-A(VEGF-A)蛋白作为一种潜在的候选子,当他们在神经干祖细胞培养液中添加VEGF-A时,神经球的形成就会明显增加。相反,利用一种药物抑制剂来阻断VEGF-A的功能就会减少低氧状况下神经球形成的增加趋势,此外,在低氧状况下,VEGF-A的表达在神经干祖细胞中还会被上调。研究者发现,利用VEGF-A处理的神经干祖细胞或会表现出较低的细胞死亡率和细胞增殖率的增加,VEGF-A是一种能在低氧状况下促进神经干祖细胞维持的特殊因子。
7.EMBO J:蛋白Yap1促进成年海马体中的神经干细胞激活
doi:10.15252/embj.2021110384
在一项新的研究中,来自德国、英国和比利时的研究人员确定了触发海马体中神经发生(neurogenesis)的分子机制中的一种称为Yap1的关键蛋白。他们发现Yap1活性的严格调控是至关重要的,因为它的失调会导致脑癌早期阶段中观察到的组织破坏。相关研究结果于2023年4月21日在线发表在EMBO Journal期刊上,论文标题为“The transcriptional co-activator Yap1 promotes adult hippocampal neural stem cell activation”。

图片来自EMBO Journal, 2023, doi:10.15252/embj.2021110384。
这些作者试图了解成年海马体中的神经发生机制。在分析RNA测序数据时,他们发现Yap1在激活的NSC中富集。这一观察促使他们对Yap1的作用进行了深入调查。
他们使用了来自成年海马体组织的原代细胞培养物,这是一种已被证实的研究NSC在静止和激活状态之间转换的模型。他们证实Yap1从细胞质转移到细胞核伴随着NSC的激活,而当NSC回到静止状态时则发生相反的情况。
他们随后在体内寻找Yap1蛋白水平异常的后果。尽管短期影响不大,但是剔除Yap1蛋白后,NSC的长期激活率下降。这证实了NSC的激活受到了Yap1的影响,而其他补偿机制尚待确定。
8.Dev Cell:揭示果蝇中激活休眠的神经干细胞来修复大脑损伤的新机制
doi:10.1016/j.devcel.2023.07.010
在一项新的研究中,来自杜克-新加坡国立大学医学院的研究人员发现了果蝇休眠神经干细胞(neural stem cell, NSC)中受伤细胞突起的再生能力。这一发现将果蝇NSC确立为揭示神经元再生秘密的强大新模型,有朝一日可能会开发出修复衰老人类大脑损伤的新疗法。相关研究结果于2023年8月10日在线发表在Developmental Cell期刊上,论文标题为“Golgi-dependent reactivation and regeneration of Drosophila quiescent neural stem cells”。
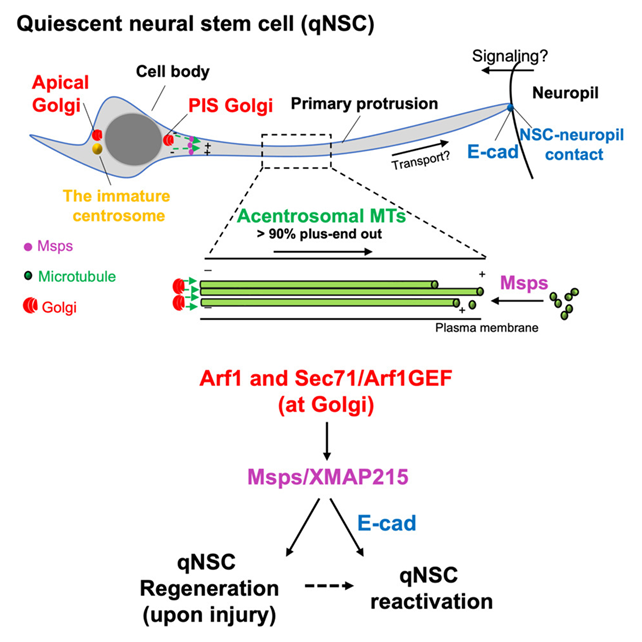
图片来自Developmental Cell, 2023, doi:10.1016/j.devcel.2023.07.010。
这项新的研究首次证实果蝇NSC中被切断的细胞突起可以再生。然而,这种能力会随着年龄的增长而下降,这反映了随着年龄增长哺乳动物神经元再生受损连接的能力有限。
他们发现,高尔基体---一种处理蛋白并将它们送往目的地的细胞器---作为休眠 NSC 的微管组织中心,对这种再生能力非常重要。微管为细胞提供结构,在细胞内运输物质,促进细胞分裂和生长,并允许果蝇发出神经元信号。他们还发现了两种高尔基体蛋白Arf1和Sec71,它们与微管结合蛋白Msps/XMAP215结合,启动了NSC中微管的生长,从而激活了休眠干细胞。同一研究小组的相关研究还揭示了微管结合蛋白Patronin与Arf1和Sec71在唤醒休眠果蝇NSCs中的关键作用。
这些作者还发现了两种高尔基蛋白Arf1和Sec71与微管结合蛋白Msps/XMAP215结合在一起,对于重新激活休眠的NSC非常重要,此外这种结合启动NSC中的微管生长从而激活休眠的NSC,也同样重要。他们的一项相关研究也揭示了微管结合蛋白Patronin与Arf1和Sec71在激活果蝇休眠NSC中的关键作用(EMBO Reports, 2023, doi:10.15252/embr.202256624)。
9.Science:在怀孕期间,成年大脑中不同的神经干细胞池经激活后短暂地产生特定类型的嗅球神经元
doi:10.1126/science.abo5199
怀孕和做母亲会导致大脑重塑。在一项新的研究中,来自瑞士巴塞尔大学的研究人员通过对小鼠的实验发现,在怀孕期间,成年大脑中不同的神经干细胞池会被激活。他们指出,它们会产生特定类型的嗅球神经元。相关研究结果发表在2023年11月24日的Science期刊上,论文标题为“Pregnancy-responsive pools of adult neural stem cells for transient neurogenesis in mothers”。

图片来自Science, 2023, doi:10.1126/science.abo5199。
在这项新的研究中,这些作者发现,在小鼠体内,怀孕会导致不同神经干细胞池的同步激活,其中许多神经干细胞池通常处于休眠状态。这导致形成了其他罕见类型的神经元,这些神经元在出生前后被暂时添加到嗅球,即大脑中处理气味信息的部分。这些神经元能确保母体在早期当母亲期间识别自己的幼崽。
这些新的神经元具有重要作用。它们使母体的嗅觉更加灵敏,以便识别幼崽。在人类中,神经干细胞也存在于相同的脑区,不过在婴儿早期之后,它们通常不会制造嗅球神经元。
论文第一作者Zayna Chaker博士说,“一些女性报告说,她们在怀孕期间嗅觉发生了变化。类似的过程也可能发生在人类身上,休眠的神经干细胞会因怀孕而被激活。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


