黑色素瘤mRNA治疗性疫苗!美国FDA授予BioNTech公司编码4抗原免疫疗法BNT111快速通道资格!
来源:本站原创 2021-11-22 00:33
BNT111是一款新型癌症免疫疗法,利用mRNA编码4种黑色素瘤相关抗原,可触发强大而精准的免疫应答。
黑色素瘤(图片来源:healthjade.com)
2021年11月20日讯 /生物谷BIOON/ --BioNTech公司近日宣布,美国食品和药物管理局(FDA)已授予BNT111快速通道资格(FTD),这是一款新型癌症免疫疗法,用于治疗晚期黑色素瘤。
快速通道资格(FTD)旨在加速针对严重疾病的药物开发和快速审查,以解决关键领域严重未获满足的医疗需求。在研药物获得快速通道资格,意味着药企在研发阶段可以与FDA进行更频繁的互动,在提交上市申请后如果符合相关标准则有资格进行加速审批和优先审查,此外也有资格进行滚动审查。
BNT111是一款癌症疫苗,是BioNTech完全拥有的FixVac平台的先导候选产品,该平台利用mRNA编码的肿瘤相关抗原的固定组合,旨在触发针对癌症的强大而精确的免疫反应。目前,BNT111正在2期临床试验(EudraCT编号:2020-002195-12;NCT04526899)中进行研究,治疗抗PD-1疗法难治性/复发性、不可切除的III期或IV期黑色素瘤患者。
FDA授予FTD的决定,基于现有的临床前和临床数据,这些数据显示BNT111有潜力克服目前在治疗无法手术治疗的难治性晚期黑色素瘤方面的局限性。通过FTD认定,BNT111的开发可以受益于与FDA更频繁的合作,这将支持收集加速BNT111开发所需的适当数据。
BioNTech联合创始人兼首席医疗官Ozlem Tureci表示:“快速通道资格(FTD)认定强调了我们FixVac平台的潜力,以解决当前已接受免疫检查点抑制剂治疗的晚期黑色素瘤患者的临床挑战,这类患者只剩下有限的标准护理治疗选项。这是在高医疗需求背景下为这一多功能新治疗方法铺平道路的重要一步。有了FDA的快速通道资格和支持,我们的目标是加快BNT111项目的进一步开发,为有生命危险、难以治疗的黑色素瘤患者提供新的治疗选择。”
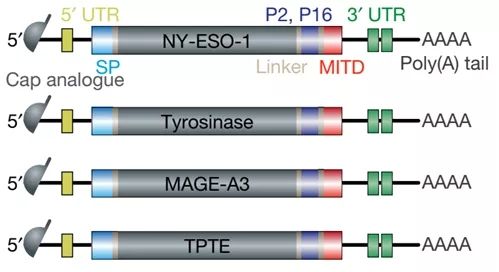
BNT111(图片来源于文献:PMID-32728218)
BNT111是一种静脉给药的治疗性癌症免疫疗法,编码一组固定的4种癌症特异性抗原,针对免疫原性进行了优化,并以RNA脂质体制剂的形式提供。根据发表在《自然》(Nature)杂志(文章标题:An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma)的正在进行的1期Lipo-MERIT单药治疗剂量递增试验的探索性中期分析的数据,
BNT111可诱导新颖的抗原特异性抗肿瘤免疫应答,并增强针对所编码的黑色素瘤相关抗原(NY-ESO-1、MAGE-A3、酪氨酸酶、TPTE)预先存在的免疫应答,这4种抗原在90%以上的皮肤黑色素瘤中表达。BNT111是BioNTech开发管线中4种临床阶段FixVac候选产品之一。
在抗PD-1疗法难治性/复发性不可切除III期或IV期黑色素瘤患者中开展的随机2期试验(BNT111-01),正在研究BNT111与Libtayo(cemiplimab)的联合作用。Libtayo(cemiplimab)是再生元和赛诺菲共同开发的抗PD-1单克隆抗体。
与再生元合作进行的BNT111-01试验在美国、英国、澳大利亚、西班牙、德国、意大利和波兰入组180例患者进入3个治疗组。该试验旨在支持正在进行的1期Lipo-MERIT单药疗法剂量递增试验(EudraCT编号2013-001646-33;NCT02410733;DOI:10.1038/s41586-020-2537-9)中报告的初始数据,这些数据表明BNT111单独或联合免疫检查点抑制剂治疗晚期黑色素瘤患者具有良好的安全性和抗肿瘤反应。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


