2021年4月HIV研究亮点进展
来源:本站原创 2021-04-30 18:44
2021年4月30日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴
2021年4月30日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的4月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Cell子刊:利用高度多重的ddPCR方法更好地检测患者体内的HIV病毒库
doi:10.1016/j.xcrm.2021.100243
在一项新的研究中,美国研究人员使用两种针对HIV基因组的3个区域(三重)的ddPCR测定方法(下称测定方法1和测定方法2)来开发一种5区域测试方法(这两种三重ddPCR测定各自针对两个独特的HIV基因组区域,但共同针对1个重叠区域,从而允许批间质量控制)。通过结合这两种平行的三重ddPCR测定方法,这些作者有信心对真正完整的HIV-1病毒基因组进行定量确定。作为进一步的改进,他们优化了其中的一种特异性定量确定T细胞的多重ddPCR测定方法,以便准确地将定量确定的数量与待研究的HIV靶细胞的数量进行正常化。这个额外的步骤对于组织活检特别有用,因为与血液相比,组织中的细胞群体难以分离和纯化。相关研究结果发表在2021年4月20日的Cell Reports Medicine期刊上,论文标题为“A highly multiplexed droplet digital PCR assay to measure the intact HIV-1 proviral reservoir”。

两种HIV-1三重ddPCR测定方法的设计,图片来自Cell Reports Medicine, 2021, doi:10.1016/j.xcrm.2021.100243。
2.Nat Commun:重大进展!发现两种主要的HIV靶细胞
doi:10.1038/s41467-021-22375-x
组织单核吞噬细胞(MNP)专门从事病原体检测和抗原呈递。所有已知的组织MNP可分为表皮CD11c+树突细胞(DC)、朗格汉斯细胞(LC)、真皮cDC1(经典1型树突细胞)、cDC2(经典2型树突细胞)、CD14+自发荧光巨噬细胞和真皮非自发荧光CD14+细胞。组织MNP将HIV传递给它的主要靶细胞;CD4 T细胞。大多数MNP HIV传播研究都集中在上皮MNP上。然而,鉴于人们如今已知粘膜创伤和炎症与HIV传播密切相关,澳大利亚研究人员在一项新的研究中,探究了存在于所有人类肛门-生殖器组织和结肠组织的上皮下(固有层和真皮)中的不同MNP亚群的作用。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Human anogenital monocyte-derived dendritic cells and langerin+cDC2 are major HIV target cells”。
这些作者利用流式细胞仪确定了每种真皮MNP亚群在人类肛门-生殖器组织和结肠组织(HIV传播发生的实际部位)中的相对比例,并同时利用腹部皮肤作为对照进行比较。他们还开发出一种方法来区分非自发荧光的CD14+CD1c−单核细胞源性巨噬细胞(monocyte-derived macrophage, MDM)和CD14+CD1c+单核细胞源性树突细胞(monocyte-derived dendritic cell, MDDC)。
这些作者发现HIV能够穿过上皮表面,与肛门-生殖器外植体上皮下的MNP相互作用,并确定了HIV在性传播过程中可能遇到的人类肛门-生殖器组织和结肠组织中存在的全部MNP亚群。在此过程中,他们确定了两个更高效摄取HIV、被HIV感染并将这种病毒传播给CD4 T细胞的MNP亚群:CD14+CD1c+ MDDC和langerin+ cDC2。
3.PLoS Pathog:抗碳水化合物抗体2G12交叉中和HIV-1和H3N2病毒,有望作为对抗有包膜RNA病毒的通用抗体
doi:10.1371/journal.ppat.1009407
在一项新的研究中,来自美国、英国和中国台湾的研究人员证实2G12在过去三十年中具有中和人类季节性H3N2病毒的能力,并通过对病毒天然HA蛋白和重组HA蛋白上的N-连接聚糖的结构生物学分析、质谱分析和进化分析来研究中和机制。在HA受体结合位点(RBS)附近的一个保守性的高甘露糖N-连接糖基化位点和一个新获得的高甘露糖N-连接糖基化位点都有助于2G12对流感病毒的这种广泛中和活性。相关研究结果近期发表在PLoS Pathogens期刊上,论文标题为“A cross-neutralizing antibody between HIV-1 and influenza virus”。
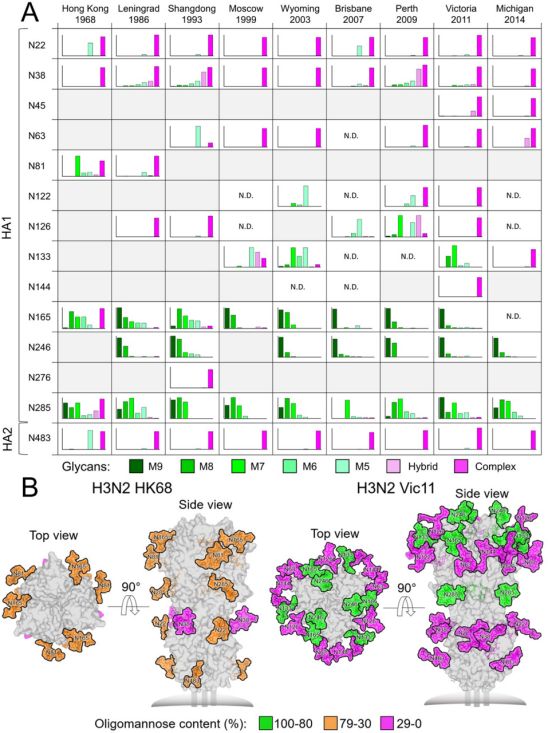
H3N2 HA糖蛋白的位点特异性N -连接糖基化及充分糖基化的HK68 HA和Vic11 HA的模型。图片来自PLoS Pathogens, 2021, doi:10.1371/journal.ppat.1009407。
这些作者揭示了2G12可以中和人类H3N2病毒,这是因为自从1968年大流行以来的H3N2进化过程中,大约30-35年前出现了N246糖基化位点。由于2G12也与HIV-1 Env上的高甘露糖表位结合,这就提出了这样的碳水化合物是否可以作为有包膜RNA病毒表面上的通用表位的问题。迄今为止,大多数针对表位有碳水化合物的病毒的抗体都是在HIV-1慢性感染的患者中发现的。虽然在HIV-1未感染的人类受试者中发现了2G12样Fab二聚化聚糖抗体和前体分子,但进一步的疫苗接种研究将阐明如何诱发2G12样抗碳水化合物抗体来对抗高糖基化的病毒。
4.Cell Rep: 新型免疫策略有助于诱导HIV-1膜蛋白三聚体广谱性中和抗体的产生
doi:10.1016/j.celrep.2021.108937
长期以来,可溶性“ SOSIP”稳定化的包膜(Env)三聚体被认为是有前途的HIV疫苗免疫原。但是,它们会诱导针对无糖化的三聚体基底部结构域的高滴度反应,而在天然病毒中该表位往往是被“掩盖”的。为了描述针对融合肽(Fusion Peptide,FP)位点的免疫原引发的靶向基地结构域的免疫反应,来自美国NIH 的John R. Mascola团队定量研究了各种SOSIP稳定化的Env三聚体和FP载体免疫策略在诱导非人类灵长类动物产生针对Env三聚体基底结构域抗体的特征。
研究结果显示:靶向三聚体基底结构域的抗体反应在仅使用三聚体膜蛋白免疫的动物中约占90%,在用SOSIP三聚体和FP结合物联合免疫的动物中约70%,在FP初免-三聚体增强的策略免疫的动物中中约30%。值得注意的是,FP引发的动物的广谱中和抗体的产生水平与靶向三聚体基底结构域的抗体产生水平呈负相关。这些结果提供了量化分析抗体反应发生率的方法,并揭示了FP接种可以减少三聚体碱基反应并改善中和结果。
首先,作者选择了49只灵长类动物(NHP)进行研究,它们被分为8组,分别接受了3种不同类型的免疫原接种:1)三聚体,2)三聚体-FP,3)FP初免(prime)+三聚体增强(boost)。第一组三包括总共23只动物,它们在第0周和第4周接受三聚体免疫,并在第6周采集血浆样品进行分析。第一组的免疫原包括BG505 DS-SOSIP或CH505 DS-SOSIP脱聚糖变体,其中 a) . 在融合肽周围去除了三个聚糖(N230,N241和N611); b) . 四个聚糖(N88,N230,N241和N611)在融合肽附近去除; 或者 c) . 在CD4结合位点(CD4bs)附近去除了三个聚糖(N197,N276和N462)(天然CH505三聚体在CD4bs附近的N362缺失了聚糖)。 CH505 DS-SOSIP免疫原进一步被构建为嵌合体,其中gp120的N和C末端以及整个gp41亚基的部分被BG505的序列取代。结果显示,CH505和BG505免疫原接种后产生的针对基底结构域的抗体反应是相同。值得注意的是,此前研究仅对三聚体中的FP特异性反应的分析,但尚未发现针对基底结构域的特异性反应。
进一步,作者检测了针对Env三聚体基底结构域的特异性血浆抗体反应。研究结果显示,针对基底结构域的Fab能够阻断单克隆抗体或血浆抗体对基底结构域的识别,但不会影响广谱性中和型抗体(bNAb)对三聚体主要侵染位点的识别。之后,作者发现在给受试动物接种FP(仅接种FP或与DS-SOSIP联合),均能够显著降低针对基底结构域的抗体的产生水平。此外,针对基底结构域的抗体反应程度以及广谱中和抗体的产生水平之间存在明显的负相关性。
5.PLoS Pathog:开发出第二代CD4CAR-T细胞,可以更有效更持久地对抗HIV感染
doi:10.1371/journal.ppat.1009404
在之前的研究和临床试验中,第一代CD4CAR(基于全长CD4构建出的CAR)的一种不好的特性是CD4受体本身能够介导HIV感染。CD4分子含有4个细胞外结构域,依次命名为D1、D2、D3和D4。D1结构域离跨膜结构域最远,含有HIV包膜结合区。HLA II类结合位点主要在D1和D2结构域发现。D4结构域介导IL-16结合和CD4-CD4二聚化。IL-16是一种免疫调节性的细胞因子,主要在炎症位点作为CD4细胞的趋化因子发挥作用。在第一代CD4CAR中,IL-16在D4结构域上的结合可导致基于IL-16的潜在非特异性的CD4CAR信号转导。CD4受体的D3结构域也在TCR:CD4复合物形成和TCR刺激中发挥重要作用。为此,需要开发一种不与IL-16发生交叉反应的降低与HLA II和内源性TCR之间相互作用的CAR,从而潜在地增加CAR的安全性。
为了克服这些问题,来自美国加州大学洛杉矶分校的研究人员在一项新的研究中,利用基于造血干细胞(HSC)的方法开发并测试了第二代基于CD4的CAR(下称D1D2CAR)抵抗HIV感染。在第二代CD4CAR中,他们剔除了CD4的D3和D4结构域,仅留下允许HIV包膜识别的D1和D2结构域,从而制造出截断的CD4CAR分子,即D1D2CAR。相关研究结果于2021年4月2日发表在PLoS Pathogens期刊上,论文标题为“Robust CAR-T memory formation and function via hematopoietic stem cell delivery”。

D1D2CAR不能介导HIV感染。图片来自PLoS Pathogens, 2021, doi:10.1371/journal.ppat.1009404。
为了研究由造血干细胞分化产生的D1D2CAR-T细胞是否能够在体内抑制HIV复制,这些作者让植入未经修饰的造血干细胞(作为对照)或经修饰后表达第一代 CD4CAR 或D1D2CAR的造血干细胞的人源化BLT小鼠被HIV感染10周。在HIV感染后每两周检测血浆病毒载量。相比于对照小鼠,植入表达第一代 CD4CAR 或D1D2CAR的造血干细胞的小鼠在10周内表现出较低水平的病毒载量。然而,由造血干细胞分化产生的CD4CAR-T细胞通过IL-16介导的CD4-CD4二聚化对Env+靶细胞(即表达HIV抗原Env的靶细胞)和IL-16刺激作出反应,相比之下,由造血干细胞分化产生的D1D2CAR-T细胞仅对ENV+靶细胞作出反应,而不对可溶性IL-16作出反应。
之前的研究表明给CAR添加共刺激结构域可能会促进CAR阳性细胞更快速产生初级反应,但是这种添加对造血干细胞定植和胸腺淋巴细胞产生的影响是未知的。为此,这些作者构建出含有4-1BB或CD28共刺激结构域的第一代CD4CAR和D1D2CAR,然后将表达第一代CD4CAR、 D1D2CAR、 第一代CD4CAR-41BB、D1D2CAR-41BB、第一代CD4CAR-CD28或 D1D2CAR-CD28的造血干细胞移植到人源化BLT小鼠的骨髓中,发现4-1BB共刺激结构域而不是CD28共刺激结构域允许成功的造血分化,并改善由造血干细胞分化而来的CAR-T细胞的抗病毒功能。加入4-1BB可导致更快速的病毒血症抑制。D1D2CAR 4-1BB和cART联合使用可导致这些小鼠更快实现病毒抑制,而且在ART治疗期间,CAR-T细胞更持久地存在。
6.EMBO Mol Med:重磅!科学家开发出能有效阻断HIV再度激活的纳米酶!
doi:10.15252/emmm.202013314
在机体感染期间,活性氧(ROS,Reactive oxygen species)能调节人类免疫缺陷病毒1型(HIV-1)的复制,然而,由于操纵细胞中抗氧化系统所产生的有害结果,将这一研究观点应用于开发新型HIV治疗策略目前仍然处于滞后阶段。日前,一篇刊登在国际杂志EMBO Molecular Medicine上题为“Antioxidant nanozyme counteracts HIV‐1 by modulating intracellular redox potential”的研究报告中,来自印度科学院等机构的科学家们通过研究就成功开发了一种新型人工酶类,其能成功阻断宿主免疫细胞中HIV-1的再度激活和复制。
研究者表示,这种由五氧化二钒纳米片(vanadium pentoxide nanosheets)制成的新型纳米酶(nanozymes)能够模拟天然酶类谷胱甘肽过氧化物酶(glutathione peroxidase)的功能,帮助减少宿主细胞中氧化性压力的水平,而宿主细胞中氧化性压力能够有效控制病毒的增殖。这种新型纳米酶的优势在于其在生物系统中较为稳定,并不会在细胞中介导任何不必要的反应,而且研究人员在实验室中制备这种纳米酶也相对容易一些。
早在几年前,研究人员Amit Singh等人就开发了一种生物传感器来实时测定HIV感染的免疫细胞中氧化性压力的水平,他表示,我们发现,要想走出潜伏期并再度被激活,HIV仅需要少量的氧化性压力;而阻止其再度激活的一种策略就是将细胞中氧化性压力保持在较低水平下,这就会将病毒锁定在一种永久的潜伏状态;而诸如谷胱甘肽过氧化物酶等酶类就是该过程非常必要的酶类,其能将毒性的过氧化氢转化为水和氧气,然而,诱导宿主细胞产生过量的这些酶类就能破坏紧密调节的细胞氧化还原机器。
几乎在同一时间,研究者Mugesh领导的研究团队发表研究证实了,由五氧化二钒所制成的特殊纳米线(nanowires)结构或能有效模拟谷胱甘肽过氧化物酶的活性,因此,研究者Singh决定与Mugesh开展联合研究。他们在实验室中制备了超薄的五氧化二钒纳米片结构,并利用这些纳米片来处理HIV所感染的细胞,结果发现,纳米片结构能像天然酶类一样有效减少过氧化氢的水平并阻断病毒的再度激活。
研究者Shalini Singh解释道,这些纳米片结构或能产生某些直接的作用效应,即对病毒再度激活的宿主基因的表达水平发生了减少。当研究人员利用这种纳米酶(纳米片结构)来处理接受抗逆转录病毒疗法(ART)的HIV感染者机体中的免疫细胞,当疗法停止时,病毒的潜伏期会被诱导地更快且病毒随后的再度激活会被抑制,这就表明,这两种手段结合起来能够更加有效地发挥抵御HIV的作用效果。
7.PNAS:新研究揭示出5种HIV潜伏促进剂,为功能性治愈HIV奠定基础
doi:10.1073/pnas.2012191118
在感染人体后,人类免疫缺陷病毒(HIV,俗称艾滋病病毒)会进入一种长时间的不活跃的潜伏状态,在免疫细胞中形成一种潜伏的病毒库。这种潜伏状态可能会持续到基因表达的随机波动(或者说噪音),或者活化细胞因子或抗原的存在会触发这种病毒的重新激活。感染者需要终身服用抗逆转录病毒药物(ART)来控制这种病毒。在治疗停止后,潜伏感染的T细胞中的HIV自发重新激活仍然是治愈HIV的主要障碍。重新激活和清除这种潜伏病毒库的疗法仅部分有效,而用于抑制重新激活和稳定化这种潜伏状态的潜伏促进剂(latency-promoting agent, LPA)仍未得到充分研究,它们的作用机制也缺乏多样性。
在一项新的研究中,来自美国伊利诺伊大学香槟分校的研究人员扩展了以前报道的基于流式细胞仪的HIV LTR启动子药物筛选,并利用自动时间推移荧光显微镜,能够测量最小HIV正向自调节基因回路上的噪声幅度(CV2)和噪声自律半衰期(τ1/2)。他们筛选了能够调控CV2和τ1/2的化合物。接下来,调节噪声的化合物在潜伏感染的全长HIV构建体上用流式细胞仪进行测试,以衡量它们在促进HIV潜伏的潜力。相关研究结果近期发表在PNAS期刊上,论文标题为“Screening for gene expression fluctuations reveals latency-promoting agents of HIV”。
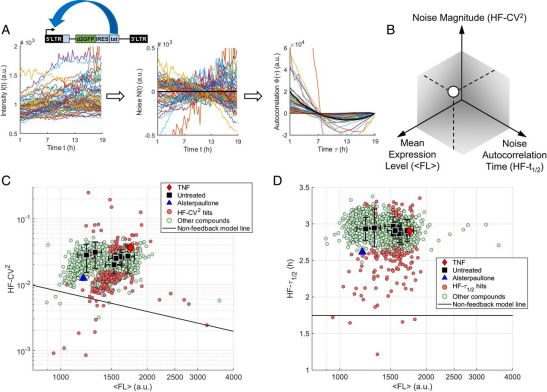
利用时间推移荧光显微镜对最小HIV基因回路进行基因表达噪声药物筛选。图片来自PNAS, 2021, doi:10.1073/pnas.2012191118。
由此可见,这项研究总共发现了5种LPA,即NSC 400938、NSC 401005、NSC 155703和两种属于Trx/TrxR抑制剂的药物,即PX12和tiopronin,以扩大目前的LPA分子库。值得注意的是,NSC 401005显示出与Trx/TrxR抑制剂的结构相似性,NSC 400938显示出与Trx/TrxR抑制剂的功能相似性。NSC 155703已被证明能抑制IL1β的分泌,其中IL1β是一种促炎因子,它的产生已被证明因HIV感染而增强。Trx/TrxR家族中的一些抑制剂,包括tiopronin和auranofin,已获FDA批准并可在市场上买到。它们已被广泛应用,从皮肤护理到抗癌治疗,从而使得对它们进行深入的研究具有吸引力。TrxR抑制剂化合物已被充分研究,而且氧化还原失衡与HIV疾病的进展直接相关。
8.Nature Immunology:以线粒体为靶点击败HIV-1
doi:10.1038/s41590-021-00898-1
CD4+T细胞的HIV-1感染触发线粒体蛋白NLRX1和FASTKD5的相互作用以促进氧化磷酸化,导致病毒复制增加。现在已经表明,该过程可以被二甲双胍阻断。基于此,Haitao Guo等人在《Nature Immunology》杂志发表了题为“Multi-omics analyses reveal that HIV-1 alters CD4+ T cell immunometabolism to fuel virus replication”的论文,阐明了导致OXPHOS增加的一种机制,并证明该途径与峰值病毒血症和更差的疾病结果正相关。此外,他们已经证明OXPHOS的这些增加可以在人类细胞和人源化小鼠中用广泛可用的药物二甲双胍抑制,减少人源化小鼠模型中的病毒血症和T细胞耗竭,这表明二甲双胍是HIV-1感染的可能疗法。
这项研究揭示了涉及NLRX1和FASTKD5的分子基础,可增加OXPHOS对HIV-1感染的反应。这会促进病毒血症,并与疾病预后不良有关。OXPHOS如何引发这种效应需要进一步分析,HIV-1促进NLRX1的确切机制也是如此。FDA批准的,廉价,安全且广泛可用的2型糖尿病药物二甲双胍可通过抑制OXPHOS降低病毒血症和病毒载量。这些发现表明,使用二甲双胍或其他线粒体抑制剂靶向OXPHOS可能有助于治疗HIV-1感染,并结合抗逆转录病毒疗法。靶向该途径不仅降低了峰值病毒血症和病毒设定点,而且还消除了T细胞耗竭,这是HIV-1感染的关键并发症,因为它导致艾滋病的进展。鉴于二甲双胍在人群中的广泛使用,回顾性检查接受二甲双胍的个体是否减少了病毒血症并减缓了疾病进展可能是有趣的。目前的研究进一步强调了免疫细胞代谢变化作为疾病驱动因素的重要性,在这种情况下是艾滋病,并预示着创新的治疗方法。
9.Cell子刊:科学家剖析HIV-1 DNA的调控机制
doi:10.1016/j.chom.2021.03.001
来自剑桥大学治疗免疫学和传染病研究所的Paul J Lehner教授带领团队,在Cell子刊《Cell Host&Microbe》杂志上发表了题为“The SMC5/6 complex compacts and silences unintegrated HIV-1 DNA and is antagonized by Vpr”的研究论文。
研究人员用病毒粒子包装的Vpr或VLP递送的Vpr观察到来自未整合的HIV-1 DNA的增强的基因表达,并且发生在原代人CD4+T细胞以及细胞系中。raltegravir非依赖性,Vpr介导的病毒基因表达增加也可能是由于未整合基因组的去阻遏,因为这种表型在稳定整合的病毒中未见。在自然感染的情况下,丰富的未整合的病毒DNA种类因此不仅仅是“死胡同”产品。它们提供了病毒基因表达的额外来源,其通过Vpr增强。在感染后的早期时间点,来自未整合病毒的基因表达因此可以促进整合的病毒基因组的成功并且形成生产性感染的基础,特别是如果病毒整合到未被很好转录的位点中。
该研究团队的研究首次描述了特异性靶向未整合的HIV-1基因组的沉默途径。Goff实验室最近将未整合的MLV逆转录病毒基因组的沉默与HUSH复合物的NP220依赖性募集联系起来,该研究团队之前显示的表观遗传沉默复合物可以抑制整合的慢病毒表达。然而,根据Goff实验室的观察,该研究团队没有发现HUSH复合物在沉默未整合的HIV-1中的作用。取而代之的是,该研究团队的筛选确定了SLF2和SMC5/6复合体在沉默未整合的慢病毒基因组(HUSH和NP220均独立)中的关键作用。
10.PNAS: CD4受体多样性展现灵长类物种抵抗免疫缺陷病毒的保护机制
doi:10.1073/pnas.2025914118
人和猿猴免疫缺陷病毒(HIV / SIV)对宿主的感染依赖于病毒包膜糖蛋白(Env)与免疫细胞表面的宿主蛋白CD4结合。尽管在人类中该结构域相对稳定,但黑猩猩CD4的Env结合域则存在高度多态性:在野生种群中有9个不同的变体。在最近发表在《PNAS》杂志上的一项研究中,来自宾夕法尼亚大学的Beatrice H. Hahn团队发现: CD4多样性并非黑猩猩独有,许多其它非洲灵长类物种中也存在上述CD4受体多样性。
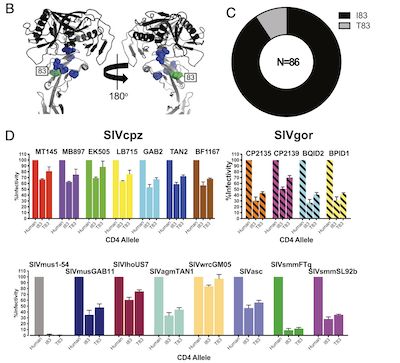
黑猩猩CD4序列多样性及其感染能力比较分析,图片来自PNAS, 2021, doi:10.1073/pnas.2025914118。
首先,作者比较了野生黑猩猩以及人类的CD4 alpha链序列差异。结果显示,人与黑猩猩的CD4 蛋白2号外显子序列完全一致,部分黑猩猩个体3号外显子83号位点存在一个氨基酸突变(I83T)。感染实验结果表明,相比人类CD4受体,两种不同变体(I83,T83)的黑猩猩CD4蛋白受一系列SIV感染的效率均明显较低。进一步,作者比较了大猩猩与人类CD4蛋白的序列差异,发现其中18,27,31,34号位点的氨基酸存在变异,其受一系列SIV感染的效率均不同程度地低于人源CD4受体。
除此之外,作者在不同类型的非洲猿类中均发现了CD4 alpha链的物种内与物种间序列多样性。这些数据表明,灵长类CD4受体处于长期平衡选择之下,并且这种多样化是灵长类慢病毒与其宿主之间共同进化“军备竞赛”的结果。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


