抗移植新药!IL-2受体靶向免疫疗法Leukotac在美国申请上市,显著延长患者生存!
来源:本站原创 2020-07-24 16:20
Leukotac用于治疗类固醇难治性急性移植物抗宿主病(SR-aGvHD)。

2020年07月24日讯 /生物谷BIOON/ --Mediolanum Farmaceutici Spa旗下公司Elsaly Biotech近日宣布,美国食品和药物管理局(FDA)已同意启动Leukotac(inolimomab)生物制品许可申请(BLA)的提交程序,用于治疗II-IV级类固醇难治性急性移植物抗宿主病(SR-aGvHD)成人患者。
该BLA将通过FDA实时肿瘤学审查试点项目(RTOR)进行审查,这是FDA肿瘤卓越中心推出的一项倡议。RTOR项目旨在探索一种更有效的审查程序,以确保患者尽早获得安全有效的治疗,同时保持和提高FDA的审查质量。
aGvHD是造血干细胞移植(HSCT)的主要并发症,是这种情况下导致发病率和死亡率的主要原因。大约有一半的aGvHD患者对最初的类固醇治疗没有反应,几乎没有其他治疗选择。
到目前为止,在欧洲对于这类患者没有批准的标准疗法,在美国仅有一种批准的标准疗法。
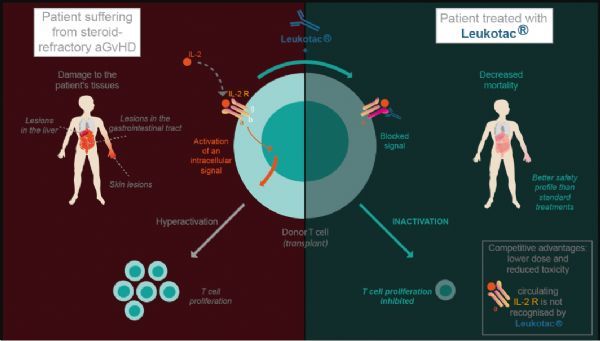
inolimomab(Leukotac)是一种免疫治疗单克隆抗体,靶向白细胞介素-2(IL-2)受体,这是一种细胞因子,有助于某些白细胞的发育和增殖,包括与aGvHD相关的T细胞。通过特异性结合该受体(CD25)的α链,inolimomab可阻断IL-2与供体过度活跃T细胞的表面,阻断其增殖。inolimomab在SR-aGvHD中的作用主要在于其对T淋巴细胞表面CD25受体的特异性和优先亲和力。
inolimomab作用机制及治疗优势(点击图片查看大图)
自2019年12月24日起,法国国家药品和保健品安全局(ANSM)批准inolimomab在SR-aGvHD适应症(也包括儿科患者)方面的临时使用授权(ATU)。这意味着,当患者不能被纳入正在进行的临床试验中时,可以考虑使用inolimomab治疗。
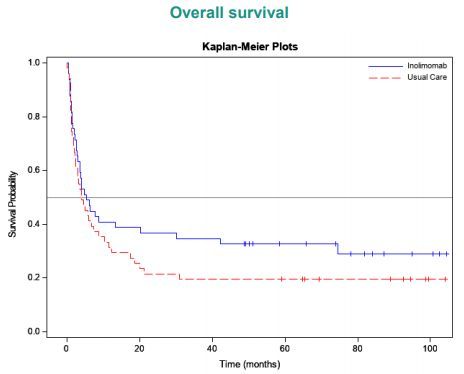
来自一项随机、多中心、对照、平行组3期研究(INO-107-EUDRACT 2007-005009-24)的数据,证实inolimomab在治疗SR-aGvHD患者方面具有强健和持久的应答率。此外,与ATG(抗胸腺球蛋白)治疗的对照组相比,inolimomab在长期生存率方面有明显优势。
随访8.5年的数据显示,inolimomab治疗组总生存率为30.6%(n=15/49),ATG治疗组为19.6%(10/51),调整后的HR=0.572(95%CI:0.346,0.947;双臂p=0.030)。这代表了总生存方面11%的绝对差异、相当于相对死亡风险降低了43%。这些结果明确地证实了inolimomab的临床益处,并表明该药是适合于II-IV级SR-aGvHD患者的一种替代治疗选择。
ElsaLys Biotech首席医疗官David LIENS博士表示:“全球范围内造血干细胞移植数量的增加,引发了对治疗aGvHD的大量新批准药物的需求,尤其是类固醇耐药型,结局往往非常差。来自1400多例接受治疗的个体中获得的可靠的临床数据(包括积极的安全性)表明,inolimomab是治疗类固醇难治性aGvHD的一种有意义的替代疗法。”
ElsaLys Biotech首席执行官兼联合创始人Christine GUILLEN博士表示:“在我们继续致力于在欧洲和美国提交销售授权申请(MAA)的同时,法国监管机构批准的ATU展示了inolimomab治疗aGvHD的价值。法国的ATU计划允许生存受到威胁的患者在inolimomab在欧洲上市之前,与主管当局ANSM密切合作,获得治疗药物。这项ATU的实施立竿见影。”(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->