HER2阳性乳腺癌临床治疗新标准!西雅图遗传学靶向抗癌药Tukysa获美国FDA批准,有效治疗脑转移!
来源:本站原创 2020-04-19 18:46
2020年04月19日讯 /生物谷BIOON/ --西雅图遗传学公司(Seattle Genetics)近日宣布,美国食品和药物管理局(FDA)已批准靶向抗癌药Tukysa(tucatinib),联合曲妥珠单抗(trastuzumab)和卡培他滨(capecitabine),用于治疗不能手术切除并且先前已接受过一种或多种抗HER2方案的晚期或转移性HER2阳

2020年04月19日讯 /生物谷BIOON/ --西雅图遗传学公司(Seattle Genetics)近日宣布,美国食品和药物管理局(FDA)已批准靶向抗癌药Tukysa(tucatinib),联合曲妥珠单抗(trastuzumab)和卡培他滨(capecitabine),用于治疗不能手术切除并且先前已接受过一种或多种抗HER2方案的晚期或转移性HER2阳性乳腺癌成人患者,包括发生脑转移的患者。Tukysa是一种靶向HER2的口服小分子酪氨酸激酶抑制剂(TKI),HER2是一种有助于癌细胞生长的蛋白质。此次批准,较FDA先前指定的目标行动日期提前了4个月之多。目前,Tukysa也正在接受欧洲药品管理局(EMA)的审查。
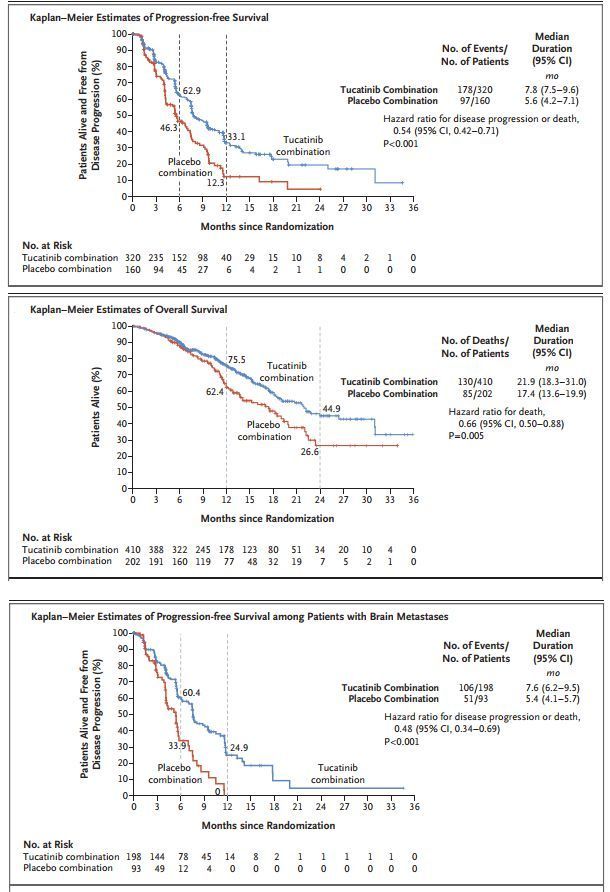
在临床试验中,与曲妥珠单抗+卡培他滨方案相比,Tukysa+曲妥珠单抗+卡培他滨方案显著延长了无进展生存期(PFS:7.8个月 vs 5.6个月)、总生存期(OS:21.9个月 vs 17.4个月)、客观缓解率提高近一倍(40.6% vs 22.8%),并且在脑转移患者中也显示出同样的疗效。对于在转移性疾病中已接受一种或多种抗HER2方案的HER2阳性乳腺癌患者,Tukysa三药方案将成为一种标准护理方案。
之前,FDA已授予Tukysa三药方案突破性药物资格(BTD)和优先审查,并根据实时肿瘤学审查(RTOR)试点项目审查了Tukysa的新药申请(NDA)。此外,Tukysa NDA也是FDA Orbis试点项目的一部分,该项目是FDA肿瘤卓越中心于2019年9月推出的一项倡议,为FDA及其国际合作的监管机构提供了一个针对肿瘤学药物的共同提交和审查的协作框架。
此次审批Tukysa,FDA与澳大利亚治疗产品管理局(TGA)、加拿大卫生部(Health Canada)、新加坡卫生科学局(HSA)、瑞士药监局(Swissmedic)合作进行了审查。这也是FDA、HSA、Swissmedic之间的第一次Oribis项目合作。虽然FDA批准了Tukysa,但其他监管机构仍在审查该药的申请。国际监管机构之间的合作旨在使监管提交可能出现重大延迟的一些国家中的癌症患者更早地获取创新抗癌药治疗,无论该药物是否已经获得FDA的批准。通过同时提交和审查肿瘤创新药的这样一个框架,Orbis项目可促进协作审查,以确定审查团队之间的任何监管分歧,这将有助于加速创新抗癌药的国际开发。
Tukysa的批准,基于关键性HER2CLIMB临床试验的数据。这是一项随机(2:1)、双盲、安慰剂对照、阳性药物对照试验,在局部晚期不可切除性或转移性HER2阳性乳腺癌患者中开展,将tucatinib与曲妥珠单抗和卡培他滨联合用药方案与曲妥珠单抗和卡培他滨联合用药方案进行了对比。该试验入组的患者先前接受过曲妥珠单抗、帕妥珠单抗(pertuzumab)、T-DM1(ado-trastuzumab emtansine)治疗,48%的患者在入组研究时存在脑转移。
结果显示,该试验达到了无进展生存期(PFS)主要终点:与曲妥珠单抗+卡培他滨方案相比,tucatinib+曲妥珠单抗+卡培他滨方案表现出更优的疗效、将疾病进展或死亡风险显著降低了46%(中位PFS:7.8个月 vs 5.6个月;HR=0.54[95%CI:0.42-0.71],p<0.00001)。在中期分析时,该试验也达到了2个关键次要终点。与曲妥珠单抗+卡培他滨治疗组相比,tucatinib+曲妥珠单抗+卡培他滨治疗组的总生存期(OS)有所提高(中位OS:21.9个月 vs 17.4个月)、死亡风险降低34%(HR=0.66[95%CI:0.50-0.88],p=0.0048)、客观缓解率提高近一倍(ORR:40.6% vs 22.8%)。对于基线时有脑转移的患者,与曲妥珠单抗+卡培他滨方案相比,tucatinib+曲妥珠单抗+卡培他滨方案也显示出优越的PFS数据(中位PFS:7.6个月 vs 5.4个月)、将疾病进展或死亡风险显著降低了52%(HR=0.48[95%CI:0.34-0.69],p<0.00001)。
该试验中,tucatinib与曲妥珠单抗和卡培他滨联合用药的安全性良好。tucatinib治疗组最常见的不良反应包括腹泻、掌跖感觉丧失性红(PPE)、恶心、疲劳和呕吐。与对照组相比,tucatinib治疗组的3级或以上不良事件包括腹泻(12.9% vs 8.6%)、天冬氨酸转氨酶(AST)升高(4.5% vs 0.5%)、丙氨酸转氨酶(ALT)升高(5.4% vs 0.5%)和胆红素升高(0.7% vs 2.5%)。不需要预防性止泻药。导致停药的不良事件在tucatinib组和对照组均不常见(分别为5.7%和3.0%)。
丹娜法伯癌症研究院SusanF.Smith女性癌症中心乳腺癌科主任Eric P. Winer表示:“鉴于关键临床试验中显示出的总生存期(OS)和无进展生存期(PFS)具有高度显著和临床重要性的结果,在先前转移性疾病治疗中已接受过一种或多种抗HER2方案的HER2阳性转移性乳腺癌患者中,Tukysa联合曲妥珠单抗和卡培他滨方案,将成为一种标准护理方案。值得注意的是,高达50%的HER2阳性转移性乳腺癌患者存在脑转移。此次批准基于一项独特的临床试验,包括了未经治疗和治疗后病情进展的活动性脑转移患者。Tukysa在这些患者中具有良好的耐受性,是治疗HER2阳性转移性乳腺癌的一个有价值的药物补充。”

HER2是一种生长因子受体,在多种癌症中过度表达,包括乳腺癌、结直肠癌和胃癌。HER2介导细胞生长、分化和存活。
Tukysa的活性药物成分为tucatinib,这是一种口服生物有效的酪氨酸激酶抑制剂(TKI),对HER2具有高度选择性,对EGFR无明显抑制作用。EGFR的抑制与显著的毒性有关,包括皮疹和腹泻。tucatinib作为单一药物、联合化疗和其他HER2靶向药物(如曲妥珠单抗)已显示出治疗活性。对tucatinib联合用药开展的临床研究显示了系统性和针对脑转移的活性。此前,tucatinib已被FDA授予治疗乳腺癌脑转移患者的孤儿药资格。
除了HER2CLIMB试验之外,西雅图遗传学公司正在开展另一项III期临床试验HER2CLIMB-02,评估tucatinib与T-DM1联合用药方案和T-DM1单药方案治疗局部晚期不可切除性或转移性HER2阳性乳腺癌。此外,该公司还正在开展一项II期临床试验MOUNTAINEER,评估tucatinib联合曲妥珠单抗治疗HER2阳性、RAS野生型、转移性或不可切除性结直肠癌。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


