近期肾脏健康相关研究进展
来源:本站原创 2020-04-13 04:23
本期为大家带来的是有关肾脏健康相关领域的研究进展,希望读者朋友们能够喜欢。
2020年4月13日讯/生物谷BIOON/---本期为大家带来的是有关肾脏健康相关领域的研究进展,希望读者朋友们能够喜欢。


据4月8日发表在《Science Translational Medicine》杂志上的一项由耶鲁大学做出的研究显示,一种用于癌症治疗的药物在逆转系统性红斑狼疮引起的肾脏损伤方面显示出了潜力。
"约一半的狼疮患者会受到肾脏损害影响,有时会导致肾功能衰竭,需要进行透析或移植,"免疫生物学教授Joe Craft说。"因此,找到造成这种损害的原因是极其重要的。"
狼疮是一种自身免疫性疾病,由免疫细胞攻击宿主体内的组织引发。其中肾脏特别容易受到影响。在狼疮性肾炎中,患者自身的T细胞浸润肾脏组织,并引发肾脏组织缺氧,从而导致组织损伤,并有可能出现晚期肾功能衰竭。
Craft等人研究了这些侵入性T细胞在狼疮性肾炎中的影响。他们发现,与狼疮有关的T细胞表达了一种叫做缺氧诱导因子-1(HIF-1)的因子,这种因子受肾脏中的氧含量调节。当HIF-1被激活时,HIF-1会指示T细胞攻击组织,进一步降低组织氧含量,造成更多的肾脏损伤。
研究人员推测,阻断HIF-1可能有助于防止肾脏组织的耗氧和损伤。对此他们使用了一种抑制HIF-1的药物(该药物已经在临床试验中被用作治疗癌症)治疗患有狼疮的小鼠。他们发现这种药物可以减缓T细胞对肾脏组织的浸润,并逆转损伤。他们还发现,在系统性红斑狼疮肾炎患者的活检样本中也存在同样的HIF-1调节的损伤。
"这些研究结果表明,这种疗法可能对狼疮性肾炎患者有益,"Craft说。"由于这种药物和其他阻断HIF-1功能的药物已经在人类癌症患者中使用,因此可以用于治疗狼疮患者。"
肾细胞功能的破坏会导致肾病综合征,这是一种由于肾脏的过滤器出现问题,导致尿液中的蛋白质异常含量增多。大约每10万个美国人中就有7个上述病症,虽然罕见,但它被认为是儿童最常见的肾脏疾病之一。
"研究人员最近发现了编码这些蛋白质的基因之一的突变,该基因被称为外胚胎复合体,它与肾脏疾病有关,"UMSOM医学系副教授、精准疾病建模中心主任Zhe Han博士说。"然而,外胚胎复合体导致肾脏疾病的潜在机制长期以来一直是个谜。"
Han博士的团队将果蝇作为模型,以更好地理解这些基因突变可能导致肾脏疾病的机制。果蝇具有专门的滤过细胞(肾脏细胞),这种细胞在结构和功能上都与人类的podocytes(一种与肾病综合征相关的肾脏细胞)非常相似。研究团队利用遗传学手段,对果蝇进行了基因筛选,并分别确定了肾小球细胞正常运作所需的8个外滤细胞基因。
沉默果蝇肾脏细胞中的果蝇外囊体基因导致一种被称为肾脏细胞裂隙膜的过滤所必需的结构被破坏。随后,研究人员用透射电镜仔细观察了超微结构的变化,发现了一种独特的电子致密管状结构的存在,他们将其命名为 "外囊棒"。"我们认为,外囊棒的形成可以作为一种新的生物标志物,用于研究外囊基因突变引起的疾病。"Han博士说。
这一发现如果得到进一步验证,将对遗传性肾脏疾病筛查患者也有重要的临床意义。"我们的研究表明,所有8个外囊基因中的突变都可能导致肾病综合征,因此应该被纳入遗传性肾脏疾病的测序靶标中",Han博士说。
Han博士和他的团队目前正在使用他们的果蝇模型来获得更多关于调节狭缝膜蛋白的机制,以及破坏上述基因如何导致疾病的发生。

根据3月25日发表于《Science Translational Medicine》杂志上的一项研究,急性肾损伤(AKI)似乎促进了单个祖细胞的乳头状肾细胞癌(pRCC)的发展。
在这项研究中,来自意大利佛罗伦萨大学的Anna Julie Peired博士及其同事研究了AKI的作用,该作用在pRCC中引起DNA损伤和修复过程,涉及细胞有丝分裂和多倍体化增加。
研究人员发现,AKI增加了人类pRCC发生和肿瘤复发的风险。在小鼠中进行的AKI诱导和长期随访结果表明,肾小管上皮细胞(TECs)的谱系追踪显示了腺瘤-癌序列中克隆乳头状肿瘤的时间依赖性发作。在与AKI相关的途径中,人pRCC中的NOTCH1过表达与较差的预后相关,并且特异于2型pRCC。在TEC中过表达NOTCH1的小鼠中出现乳头状腺瘤和2型pRCC; AKI加快了这一过程。通过沿袭谱系在小鼠中,单个肾祖细胞被鉴定为乳头状肿瘤的起源细胞。人肾祖细胞转录组显示与PT1相似,PT1是单细胞RNA测序中建议的人pRCC起源细胞。在培养的人肾祖细胞中,NOTCH1过表达诱导肿瘤样三维生长。
作者写道:“总而言之,这项研究的结果提供了证据,表明急性器官损伤可以驱动肿瘤发生,特别是AKI通过经典的腺瘤-癌序列促进单个肾祖细胞发展。”

在最近发表在《Journal of the American Society of Nephrology》杂志上的研究中,研究者们通过分析数百名患有糖尿病的芬兰人的样本,鉴定了可能与糖尿病性肾病发展有关的基因及其编码的蛋白质。
糖尿病性肾病是一种严重的,在患有1型和2型糖尿病的人中发生的并发症。它会影响肾脏从体内过滤掉多余的水和废物的能力,并导致高血压,四肢肿胀,注意力不集中,疲劳,并可能导致肾衰竭。
“研究表明,糖尿病性肾脏疾病倾向于在某些特定家庭中传播,提示其遗传易感性,”文章作者Karl Tryggvason教授解释说。然而,要想找到特定的基因仍然是一个挑战,因此,科学家们仍然还不清楚糖尿病肾脏疾病在分子水平上是如何发展的。
研究小组比较了76对芬兰兄弟姐妹的基因组,这些人群都患有1型糖尿病超过15年,但同胞兄弟(姐妹)之间只有一个患有糖尿病性肾脏疾病。对此,作者试图在基因组,基因和单突变水平上寻找之间的差异。然后,他们通过分析3,500多名与1型糖尿病无关的芬兰人的基因来验证他们的结果,其中近40%的人患有糖尿病性肾脏疾病。
“我们的分析揭示了几种可能通过编码蛋白激酶C的基因突变,或许参与了疾病的发生。”这些蛋白质对于参与过滤肾脏内部血液的细胞功能至关重要,并且可能是治疗糖尿病性肾脏疾病的诱人靶标。

在本月发表在《Kidney International》杂志上的一项研究中,来自日本东京医科牙科大学(TMDU)的一组研究人员发现,慢性肾脏病(CKD)患者的免疫系统与高血压之间存在内在联系。
CKD影响全球近8亿人,并且是每年造成100万人死亡。 CKD的主要并发症之一是高血压。研究表明,控制血压是防止CKD恶化的重要因素。但是,许多CKD患者显示出更高的盐敏感性,在这种情况下,血压会受到饮食中盐摄入量的过度影响,因此很难控制。
WNK-SPAK-NCC磷酸化途径的过度激活会增加肾脏中盐的重吸收,从而导致对盐敏感的高血压症状。但是,该途径是否会引起CKD患者高血压以及调节磷酸化级联反应的因素尚未得到研究。
使用疾病的小鼠模型,研究人员证实患有CKD的小鼠肾脏中WNK1蛋白的水平升高,从而导致下游蛋白SPAK和NCC的激活增加。当进食高盐饮食时,CKD小鼠中的WNK-SPAK-NCC途径仍处于激活状态,从而导致对盐敏感的高血压症状发生。
然后,研究人员回顾一些最近的研究,这些研究表明免疫系统可能在盐敏感性中起作用。研究结果显示,CKD小鼠肾脏中促炎性细胞因子TNF-α的水平升高,外源TNF-α刺激则同样能够导致WNK1的水平升高。
作者Eisei Sohara博士说:“有趣的是,TNF-α并未增加WNK1的转录,提示它以某种方式阻止了成熟WNK1蛋白的降解。基于这个假设,我们证实了TNF-α通过阻止NEDD4-2 E3-连接酶(通常降解成熟WNK1的蛋白质)的转录来提高WNK1蛋白的水平。”通过抑制TNF-α,研究人员能够逆转高盐饮食喂养的CKD小鼠的盐敏感性,从而证实了免疫系统与盐敏感性之间的联系。
噻嗪类利尿剂(NCC抑制剂)是广泛使用的降压药,但其疗效在CKD患者中有所不同。为了获得更加有效的药物,重要的是预先预测药物的疗效。。因此,这项研究的发现可能有助于将来更好地选择降压药。

并非所有癌细胞都是一样的。肿瘤中含有强有力的癌症干细胞(cancer stem cell,也译作肿瘤干细胞,癌干细胞),这些癌症干细胞会产生转移性肿瘤,如果它们逃避治疗,那么它们就会让疾病复发。如果科学家们能够分离出它们并探究其弱点,这将使它们成为治疗的重要靶标。但是这些细胞通常非常稀少,以至于尚未在许多类型的癌症中发现它们。
Birchmeier及其团队鉴定出肾癌干细胞并发现它们存在的弱点。它们依赖于两种关键的生化信号。在这种疾病的多个实验室模型中,阻断这两种生化信号就会阻止肿瘤生长,这提示着一种有前景的治疗人类肾癌患者的新方法。
两个生化弱点
Fendler说,“我们对这些细胞的分析表明,它们依赖于通过称为WNT和NOTCH的两个生化途径传递的信号。”鉴于已知这两种途径在其他类型的癌症中也起着作用,Birchmeier团队已经学会了如何破坏它们。他们已经开发出一种强效的WNT信号抑制剂。
人们以前未曾猜测WNT和NOTCH在肾脏肿瘤中起作用;这两种生化途径中的突变很少在这种疾病中发现。但是,这两个信号均与一个称为VHL的肿瘤抑制基因相关,而该基因与ccRCC密切相关。这些新发现表明阻断WNT、NOTCH或同时阻断这两种信号均可能靶向这些癌症干细胞并干扰这种肿瘤中最具侵袭性的成分。
在临床上,针对癌症患者的治疗中,靶向各种生化途径的抑制剂正逐渐取代化疗药物。 Fendler说,“但是你必须知道你想要靶向的生化途径,而对ccRCC生物学特性的了解还不够。”
多种模型系统的前景
对这些新的抑制剂的初步测试是有希望的。Birchmeier说,“值得注意的是,来自患者的四分之三的细胞培养物至少对一种抑制剂有反应,其余50%的细胞在两种抑制剂的存在下受到抑制。”
但是在这时,Birchmeier实验室面临着癌症研究时存在的一种主要挑战。Birchmeier说,“我们在实验室中了解到的东西通常很难转化为患者的真实情况。从其他实验室获得的常规细胞系培养物和动物模型不能反映人体内疾病的复杂性。”采取的一种解决方案是开发更多类型的更接近人类疾病的模型系统。
Birchmeier和他的同事们已很擅长从肾癌患者身上提取癌症干细胞,让它们在体外培养液中生长,并用一系列不同的药物处理它们。他们与德国EPO(Experimental Pharmacology and Oncology)公司合作还将肾癌患者的癌症干细胞移植到了小鼠体内,这样这些小鼠产生的肿瘤与人体内的肿瘤几乎相同。这些小鼠在寻找治疗方法的过程中是必不可少的:治愈它们携带的人类肿瘤的方法可能也适用于患者。在当前的这个研究项目中,EPO公司将WNT抑制剂和NOTCH抑制剂单独地和和组合地注射到荷瘤小鼠中,并观察发生了什么。结果表明阻断这两个生化信号是最有效的策略。但是这在人类患者中是否同样有效?
一种新的模型系统
最近,科学家们学会了使用患者细胞产生类器官(organoid):器官的微型版本,它包含许多类型的细胞。它们是由人体组织构成的,但是利用它们进行药物测试不存在对人类患者进行类似测试时面临的伦理问题。人们已经为健康的肾脏、其他多种器官和诸如结肠癌之类的肿瘤构建出类器官。
Fendler说,“其他研究团体曾尝试构建针对ccRCC的类器官,但效果不大好。所构建出的类器官不能很好地生长或不能产生类器官。这两个因素在开发药物测试和治疗的模型中都很重要。患有这种疾病的患者需要快速和可靠的模型来测试治疗反应。”
不同的模型系统,类似的结果
Birchmeier说,“这项研究中最关键的发现是鉴定WNT和NOTCH信号转导系统在ccRCC中起着至关重要的作用,并发现抑制它们对肿瘤有影响。”不过,不同模型系统之间仍然存在细微的差异,针对这些差异仍需加以探索;目前,仍需要对小鼠进行研究。

2019年12月到2020年2月,发生的新型冠状病毒(2019- nCoV)感染肺炎(NCIP),已对公共卫生构成严重威胁。
ACE2(血管紧张素转换酶2)已被证明是介导2019-nCoV进入人类细胞的主要受体之一,这种情况也发生在严重急性呼吸综合征冠状病毒(SARS)中。多项研究表明,部分患者除了呼吸系统损伤外,还有肾功能异常甚至肾脏损伤,其机制尚不清楚。这引起了研究人员对冠状病毒感染是否会影响泌尿系统和男性生殖系统的兴趣。
近日来自南京医科大学附属苏州医院泌尿外科研究团队的研究人员使用在线数据集来分析ACE2在不同人体器官中的表达,他们在medRxiv上文报道,研究结果表明,ACE2在肾小管细胞、间质细胞和睾丸输精管细胞中均有高表达。因此,病毒可能直接与此类ACE2阳性细胞结合,损伤患者的肾脏和睾丸组织。
研究人员认为,2019-nCoV患者在临床工作中应进行肾功能评估和特殊护理,因为病毒和抗病毒药物对肾脏有一定的毒性。此外,由于该病毒对睾丸组织的潜在致病性,临床医生应注意患者住院期间及后期临床随访中睾丸病变的风险,特别是对年轻患者生育能力的评估及适当干预。
近日,一项刊登在国际杂志Scientific Reports上的研究报告中,来自杜塞尔多夫大学等机构的科学家们通过研究开发了一种新方法,其能重复分离并鉴定来自不同年龄、性别和种族捐赠者的肾脏干细胞、尿源性肾祖细胞(UdRPCs,urine derived renal progenitor cells)。肾脏发挥着多种关键功能,比如其会维持机体液体水平的平衡,从食物、药物和有毒物质中过滤废物,以及调节血压水平等。目前全球肾脏相关疾病的流行不断增加,大约19%-26%的急性肾脏损伤(AKI)都是由肾毒性药物所诱发的,急性肾脏损伤最终会进展为慢性肾脏疾病(CKD)并增加患者死亡的风险,糖尿病、全身性高血压和肾小球病是诱发CKD的主要原因。CKD是一种全球健康和经济负担,同时其还是诱发心血管疾病独立的风险因素,由于缺乏何时的器官捐赠者,基于干细胞的疗法就被认为是一种用于治疗肾脏相关疾病的可替代方法;截止到目前为止,研究人员利用骨髓、脐带血和羊水建立了多种成体干细胞来源,尽管这些来源拥有多种具有再生潜能的干细胞,但其使用价值非常有限,脐带血和羊水只能在出生前和出生时获取,而骨髓则需要侵入性的步骤,这常常与病人的风险和疼痛有关,肾脏活组织检查则用于产生用于研究的人类肾脏细胞。
每天大约有2000-7000个细胞会从肾脏排出进入尿液中,尽管多个实验室研究表明,尿液是肾脏干细胞的另一种来源,但迄今为止,研究人员并未对这些细胞进行全面的分析。这项研究中,研究人员从10例不同年龄和性别的个体机体中分离到了尿源性肾祖细胞(UdRPCs),他们发现,这些细胞能够表达骨髓衍生的间充质干细胞(MSCs)中所见到的典型标志物,此外,其还能表达肾脏干细胞标志物SIX2, CITED1, WT1, CD24和CD106;UdRPCs能够分化为肾脏中存在的多种细胞类型,包括近端、远端小管和足细胞。
研究者Wasco Wruck说道,让我们想不到的是,这些有价值的细胞竟然能从尿液中分离得到,我们还能将UdRPCs与肾脏活组织中衍生的细胞中所有表达的基因进行对比,来证实肾脏足细胞的特性和来源。值得注意的是,UdRPCs能够组装并能像羊水来源干细胞(AFCs)一样,此外,其还能容易且有效地重编程为诱导多能干细胞。
近日,一项刊登在国际杂志Cancer Discovery上的研究报告中,来自德州大学西南医学中心等机构的科学家们通过研究鉴别出了肾脏肿瘤的新型易感特性;研究者指出,抑制名为TBK1的酶类或许有望帮助开发治疗肾脏癌症的新型疗法。
肾癌会对最先进的疗法产生一定的耐药性,因此研究人员就需要开发出新型疗法;此前研究结果表明,70%-80%的肾癌都会表现出名为VHL的关键肿瘤抑制基因功能的缺失状况,该基因蛋白功能的缺失能够模拟多种实体瘤在低氧状况下生长的情况。基于此前研究结果,这项研究中,研究人员旨在识别出能够有效抵御VHL蛋白功能缺失的肾癌的新型酶类。
研究者Qing Zhang说道,我们鉴别出了一种名为TBK1(TANK-binding kinase 1)的酶类,其在VHL功能缺失的肾癌患者机体中处于高度活性状态,TBK1是一种在先天性免疫力中扮演关键角色的酶类,为了在癌症背景下研究该酶类的活性,研究人员对多种VHL蛋白缺失的转移性肾透明细胞癌(ccRCC,clear cell renal cell carcinoma)细胞系进行研究来观察当TBK1活性降低后会发生什么,随后他们利用CRISPR基因编辑技术移除了能制造TBK1的基因,降低了该酶类的活性,并利用小分子降解了TBK1蛋白,结果发现,抑制TBK1活性或能减缓或阻断癌细胞的生长。
当对癌细胞和健康细胞进行对比研究,利用小分子阻断TBK1活性后,研究者发现,这种新型策略能够有效抑制VHL缺失的ccRCC细胞中肿瘤的生长,同时并不会影响健康细胞中正常VHL蛋白的水平,这就表明,这种新型策略具有选择性致死性,其能杀灭癌细胞还不会损伤健康细胞。缺氧被认为会在大部分肿瘤中发生,因此本文研究具有非常重要的临床意义。
研究者指出,缺氧会通过与VHL缺失相同的机制来增加TBK1的活性,我们认为,靶向并操控TBK1的活性或许能让癌症患者获益;TBK1对于先天性免疫系统对抗病毒反应中的细胞信号转导非常重要,因此研究人员就想通过研究来阐明是否蛋白质的免疫系统活性与他们在肾癌患者中所观察到的效应有关,随后他们对TBK1剔除的癌细胞进行研究来观察是否控制细胞先天性免疫反应的基因所制造的蛋白质会受到影响,研究结果表明其并不会受到影响;因此,TBK1在癌症中所扮演的角色或许不同于其在免疫系统中扮演的角色。
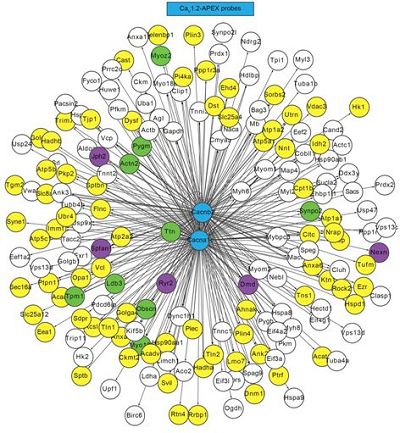
我们都感受到了肾上腺素冲击的影响。在身体准备对抗或逃离无论是真实的还是想象的威胁时,心跳加速,呼吸加快,肌肉绷紧。
肾上腺素在引发战斗或逃避反应(fight-or-flight response)中的作用是生物学中研究最深入的现象之一。然而,这种激素如何刺激心脏功能的确切分子机制仍不清楚。
这些研究人员通过使用一种称为邻近蛋白质组学(proximity proteomics)的技术,发现在正常条件下,一种名为Rad的蛋白质会抑制钙通道的活性。当心脏细胞暴露于一种模拟肾上腺素的药物时,Rad从钙通道释放出来,从而导致这种钙通道活性的增加和更强的心脏跳动。这些发现提供了肾上腺素如何刺激心脏的机制描述并为心血管药物发现提供新靶标。
这些作者说,特别地,这些结果可能为开发与β受体阻滞剂同样有效但可能比β受体阻滞剂更安全的药物开辟了新途径。β受体阻滞剂是一类广泛使用的处方药物,可阻断肾上腺素的作用,以解决诸如高血压之类的心血管问题。
Kalocsay说,“在正常情况下,心脏中的钙通道可以有效地起作用,但是它们存在起着手刹作用的Rad蛋白。当我们需要全力时,肾上腺素会释放这种手刹,以便这些钙通道打开得更快,从而给我们提供对抗或逃离危险所需的动力。”
这些作者指出这些发现为其他领域(特别是神经科学)的研究人员提供了有趣的新见解,这是因为电压门控钙通道在神经元兴奋中起着重要作用。
缺失的环节
作为心脏功能的主要驱动力,电压门控钙通道嵌入在心肌细胞的细胞膜中。这些通道打开和关闭以控制钙离子流入心肌细胞。当它们打开时,钙离子的流入会引发心脏收缩。
肾上腺素通过激活一种称为PKA的蛋白来刺激电压门控钙通道,进而激活这种钙通道。几十年来,人们一直认为PKA通过改变这种钙通道上称为PKA磷酸化位点的特定区域来做到这一点,但是越来越多的证据表明这一假设是错误的。
这些研究人员采用了近距离蛋白质组学,即一种允许他们鉴定电压门控钙通道附近(距离大约20nm)的几乎每种蛋白的技术。在暴露于肾上腺素样药物之前和之后,他们分析了小鼠心肌细胞和完整的功能性小鼠心脏中的蛋白。
这一分析显示,仅蛋白Rad在肾上腺素暴露后始终表现较大的水平变化,它在电压门控钙通道附近降低了大约30%至50%。
为了进一步开展研究,这些研究人员让正常情形下不表达Rad和电压门控钙通道的人肾细胞表达它们,从而在心脏细胞外面来重建这种信号转导系统。当同时表达Rad和钙通道的人肾细胞暴露于肾上腺素样药物时,这种钙通道的活性急剧增加。缺乏Rad的人肾细胞几乎没有反应。他们说,到目前为止,由于缺少作为重要成分的Rad,所以不可能以这种方式重现钙通道调节。
进一步的实验证实了Rad的功能是抑制电压门控钙通道的活性。当给予肾上腺素样信号时,PKA会修饰Rad蛋白的特定区域,Rad蛋白随后从钙通道脱离下来以增加钙通道的活性。
鉴于电压门控钙通道在多种器官功能中起着至关重要的作用,这一发现开辟了新的研究途径。
此外,这项新的研究中使用的技术,包括定量质谱和串联质谱标记技术,允许人们能够以前所未有的精度探测蛋白生物学和相互作用,包括完整的功能性器官中的蛋白行为。
这些研究人员说,这些发现有助于开发为新的治疗方法。比如,破坏Rad和钙通道之间的相互作用可能通过增加钙流入细胞来增强心脏功能。相反,阻断PKA对Rad的修饰可能代表着另一种比β受体阻滞剂更精确的减少钙离子流入心脏的策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


