精神分裂症新药!ICT公司Caplyta(lumateperone)治疗急性加重期患者展现强劲疗效,即将上市!
来源:本站原创 2020-02-22 15:07
2020年02月22日讯 /生物谷BIOON/ --Intra-Cellular Therapies(ICT)是一家专注于开发创新疗法治中枢神经系统(CNS)疾病的生物制药公司。近日,该公司宣布,评估Caplyta(lumateperone)治疗精神分裂症成人患者的III期临床试验(ITI-007-301)结果已发表于《美国医学会杂志-精神病学》(JAMA

2020年02月22日讯 /生物谷BIOON/ --Intra-Cellular Therapies(ICT)是一家专注于开发创新疗法治中枢神经系统(CNS)疾病的生物制药公司。近日,该公司宣布,评估Caplyta(lumateperone)治疗精神分裂症成人患者的III期临床试验(ITI-007-301)结果已发表于《美国医学会杂志-精神病学》(JAMA Psychiatry)。文章标题为:Efficacy and Safety of Lumateperone for Treatment of Schizophrenia: A Randomized Clinical Trial。
Caplyta于2019年12月获得美国食品和药物管理局(FDA)批准,用于精神分裂症成人患者的治疗。用药方面,Caplyta的推荐剂量为42mg,每日一次,与食物同服,不需要剂量滴定。需要注意的是,Caplyta的药物标签中含有一则黑框警告,提示:老年痴呆相关精神病患者使用抗精神病药物治疗,死亡风险增加;Caplyta未被批准用于治疗痴呆相关精神病患者。ICT公司此前表示,将在2020年一季度末将Caplyta推向市场。
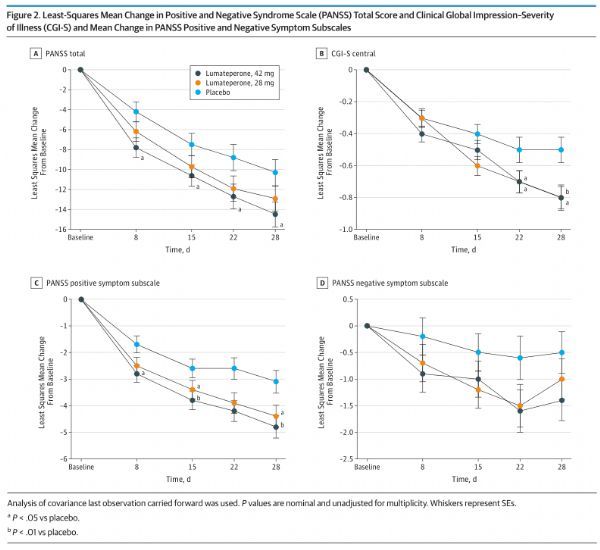
ITI-007-301是一项随机、双盲、固定剂量、安慰剂对照III期临床试验,在美国12个临床中心开展,共入组了450例患者,这些患者采用DSM-5标准诊断为精神分裂症、并且有精神病症状急性加重。研究中,患者被随机(1:1:1)分配,接受Caplyta 42mg、28mg、安慰剂,每日早晨服药一次,治疗4周。预先指定的主要疗效评价是中心评定的阳性和阴性症状量表(PANSS)总评分从基线至研究结束(第4周)的变化。关键次要终点是中心评定的临床总体印象-疾病严重程度量表(CGI-S)评分。入组研究的患者,基线PANSS平均分为89.8,表明明显患病。研究中的28mg剂量不是Caplyta的批准剂量。
结果显示,Caplyta 42mg剂量达到了主要终点,采用第4周PANSS总评分相对基线的变化评价,显示出抗精神病疗效,与安慰剂相比具有统计学上的显著优势(药物-安慰剂差异:-4.2分)。此外,Caplyta 42mg也达到了CGI-S评分在统计学上显著改善的关键次要终点。Caplyta 42mg剂量早在第1周就显示出显著的抗精神病疗效,并且在整个研究的每个时间点都保持这种疗效。
研究中,Caplyta 42mg组发生率≥5%且是安慰剂组2倍的最常见不良事件包括嗜睡(17.3% vs 4.0%)、镇静(12.7% vs 5.4%)、疲劳(5.3% vs 1.3%)、便秘(6.7% vs 2.7%)。与安慰剂相比,在体重、胆固醇、甘油三酯、葡萄糖、胰岛素、催乳素水平等代谢参数上没有显著差异。在任何治疗组中,锥体外系症状(EPS)相关的治疗出现的不良事件(TEAE)发生率不超过5%。
纽约霍夫斯特拉/诺思韦尔祖克医学院精神病学和分子医学教授Christoph Correll博士表示:“Caplyta 42mg剂量治疗显著改善了精神分裂症急性加重期患者的症状,具有良好的耐受性。Caplyta代表了医疗保健提供者在处理这种异质性精神状况方面的一个重要补充。”

精神分裂症(schizophrenia)是一种严重的精神疾病,影响美国约240万成年人。精神分裂症的临床表现多种多样。急性发作的特点是精神病症状,包括幻觉和妄想,往往需要住院治疗。这种疾病是慢性和终身的,常伴有抑郁和社会功能和认知能力的逐渐恶化。精神分裂症患者常因体重增加和运动障碍等副作用而停止治疗。
Caplyta的活性药物成分为lumateperone,这是一种首创的(first-in-class)小分子药物,可选择性且同时调节5-羟色胺、多巴胺及谷氨酸这3种涉及严重疾病的神经递质通路。与现有的精神分裂症药物不同,lumateperone是一种多巴胺受体磷酸蛋白调节剂(DPPM),在D2受体上充当突触前部分激动剂和突触后拮抗剂。这种机制,连同与5-HT2A受体、5-羟色胺转运体及D1受体的潜在相互作用以及间接的谷氨酸调节作用,可能有助于lumateperone在横跨一系列精神症状方面的疗效,具有改善的心理社会功能和良好的耐受性。这种化合物有可能使罹患一系列神经精神障碍和神经退行性疾病的患者受益。
在美国,FDA已于2017年11月授予lumateperone治疗精神分裂症的快速通道地位。除了精神分裂症之外,ICT公司也正在开发lumateperone治疗其他精神疾病,包括痴呆患者行为障碍、阿尔茨海默病、抑郁症和其他神经精神和神经疾病。
2019年7月,lumateperone作为单药疗法治疗双相I型障碍或双相II型障碍相关重度抑郁症的2项III期临床研究(Study 401,Study 404)的顶线结果。数据显示,在404研究中,与安慰剂组相比,lumateperone 42mg达到了改善抑郁症的主要终点(p<0.001)和改善抑郁严重程度的关键次要终点(p<0.001)。但在401研究中,由于安慰剂组临床应答很高,2种剂量lumateperone(42mg和28mg)均未达到主要终点。2项研究中lumateperone表现出良好的安全性且耐受性良好。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->