2019年度巨献:癌症免疫疗法重磅级研究成果!
来源:本站原创 2019-12-27 21:54
时光总是匆匆易逝,转眼间,2019年就要结束了,在即将过去的一年里,科学家们在癌症免疫疗法研究领域取得了哪些重要的研究成果呢?本文中,小编对相关重要的研究成果进行整理,分享给大家!图片来源:Emory University【1】Immunity:阐明T细胞“耗尽”的机制有望改善癌症免疫疗法doi:10.1016/j.immuni.2019.11.002近日,
时光总是匆匆易逝,转眼间,2019年就要结束了,在即将过去的一年里,科学家们在癌症免疫疗法研究领域取得了哪些重要的研究成果呢?本文中,小编对相关重要的研究成果进行整理,分享给大家!
图片来源:Emory University
【1】Immunity:阐明T细胞“耗尽”的机制有望改善癌症免疫疗法
doi:10.1016/j.immuni.2019.11.002
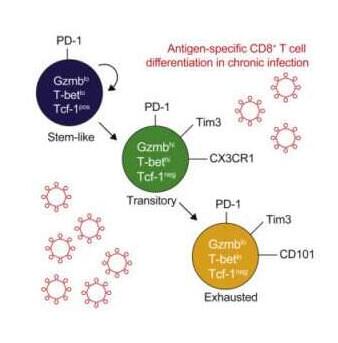
近日,一项刊登在国际杂志Immunity上的研究报告中,来自埃默里大学的科学家们通过对慢性病毒感染所致的免疫细胞“耗尽”(exhausted)进行研究为如何完善癌症免疫疗法提供了新的线索;文章中,研究人员对小鼠机体中耗尽的CD8 T细胞进行研究,当存在持续性病毒感染或癌症时,CD8 T细胞就会失去抵御疾病的能力,同时还会在其表面展示出抑制性检查点蛋白,比如PD-1,PD-1能被癌症免疫疗法药物靶向作用,比如派姆单抗和纳武单抗等,其能促进CD8 T细胞重新获能攻击并杀灭感染的细胞和癌症。
目前这些药物已经被FDA批准用来治疗多种类型癌症,然而有些肿瘤并不会对其产生反应,对耗尽的CD8 T细胞进行研究或能帮助理解如何利用自身的免疫系统来抵御癌症或慢性感染。此前研究中,研究人员发现,耗尽的细胞并不都是一样的,耗尽的T细胞池中的多样性或能帮助解释机体对癌症免疫疗法反应的可变性;尤其是,研究者观察到了一类干细胞样细胞,其能不断增殖以对PD-1阻断药物产生反应,同时一种更具分化特性的耗尽细胞群则会保持失活状态,这些干细胞样细胞能够维持耗尽T细胞群,但并不会杀灭病毒感染的细胞或肿瘤细胞。
【2】Immunity:表达瘦素的溶瘤病毒促进T细胞清除肿瘤,有望开发出新的癌症免疫疗法
doi:10.1016/j.immuni.2019.07.003
尽管细胞毒性T细胞使用许多不同的效应途径杀死受感染或者癌变的细胞,但是它们通常不能有效地清除实体瘤。在某些情况下,T细胞根本无法进入致密的肿瘤组织。在其他情况下,T细胞遭受衰竭,无法发挥效应功能。肿瘤通过减少组织的氧合作用和养分,极大地改变它们的局部环境,从而使得T细胞代谢不足并阻止这些细胞发挥功能。对T细胞进行代谢重编程以增加葡萄糖摄取或保持线粒体功能能够增强抗肿瘤反应。
在一项新的研究中,为了在恶劣的肿瘤微环境中维持抗肿瘤T细胞,来自美国匹兹堡大学的研究人员巧妙地选择了细胞因子瘦素(leptin)来重编程T细胞代谢,相关研究结果发表在Immunity期刊上;已知瘦素在人体代谢和肥胖中起主要作用,但这种蛋白在很大程度上已被肿瘤免疫学家忽略。利用瘦素受体在T细胞中的稳态表达以及在肿瘤浸润T细胞中的上调表达,这些研究人员首次证实外源性瘦素体外孵育可增强T细胞代谢和增殖。将溶瘤牛痘病毒(VACV,一种溶瘤病毒)直接注射到小鼠肿瘤中实现瘦素局部递送,就可改善T细胞到肿瘤中的招募和提高T细胞线粒体含量。
【3】Cell:科学家成功筛选出开发新型癌症免疫疗法的关键靶点
doi:10.1016/j.cell.2019.07.044
在过去10年里免疫疗法给癌症治疗带来了革命性的变革,然而很多肿瘤对这些新型疗法并没有反应,近日,来自耶鲁大学的科学家们通过研究对T细胞中2万个人类基因进行全基因组筛选,鉴别出了多个新型候选基因,其能促进机体免疫系统攻击多种类型的肿瘤,相关研究结果刊登在国际杂志Cell上。
研究者Sidi Chen教授说道,免疫疗法对于所有患者并非都有效果,大约70%-80%的患者对疗法并无反应;那么我们为何不从基因层面进行研究来分析哪些基因主要负责肿瘤生长,同时寻找开发新型癌症疗法的潜在靶点;很多免疫疗法都基于抑制PD1基因而开发,PD-1能抑制T细胞动员并攻击肿瘤细胞的能力,这些疗法明显提高了多种类型癌症患者的存活率,比如黑色素瘤和肺癌等,然而即便在这些癌症中,也仅有30%-40%的患者对免疫疗法能产生反应,对于大多数癌症类型而言,患者的反应率在20%以下,某些恶性肿瘤患者的反应率甚至在10%以下。
【4】Nature重大进展!发现癌细胞上新的“别吃我”信号,新的免疫疗法即将来临
doi:10.1038/s41586-019-1456-0
日前,一项刊登在国际杂志Nature上的研究报告中,来自斯坦福大学医学院的研究人员发现了一种新的信号,癌症似乎可以利用这种信号逃避免疫系统的检测和破坏。科学家们已经证明,在植入人类癌症的老鼠体内阻断这种信号可以让免疫细胞攻击癌症。阻止其他"不要吃我"的信号已经成为其他可能的抗癌疗法的基础。通常,被称为巨噬细胞的免疫细胞会检测到癌细胞,然后吞噬它们。近年来,研究人员发现,细胞表面的蛋白质可以告诉巨噬细胞不要进食并摧毁它们。这可以帮助正常细胞阻止免疫系统攻击它们,但是癌细胞利用这些"不要吃我"的信号来躲避免疫系统。
此前研究人员发现,癌症细胞利用PD-L1、CD47保护自己免受免疫细胞的侵袭。阻断CD47的抗体正在临床试验中。以PD-L1或PDL1受体为靶点的癌症治疗正在临床得到应用。斯坦福大学的研究人员现在报告说,他们发现一种名为CD24的蛋白质也可以作为"不要吃我"的信号,并被癌细胞用来保护自己。
【5】Nature Nat Medicine:癌症免疫疗法新突破!工程化细菌充当“特洛伊木马”有效抑制肿瘤进展!
doi:10.1038/s41591-019-0498-z doi:10.1038/nature18930
目前,合成生物学的新兴领域—设计新型的生物组分和系统正在彻底改变医学的进展,通过对活细胞的遗传编程,研究人员就能够开发出智能感知并对多种环境做出反应的工程化系统,与当前基于分子的疗法相比,这种新型系统能够产生更加具体且有效的解决策略。
在过去十年里,癌症免疫疗法(即利用患者自身的免疫防御力来抵御癌症)给癌症治疗带来了革命性的变化,但仅有一小部分实体瘤会对这种疗法产生反应,而且系统性的治疗通常会给患者带来明显的副作用,设计出一种能在实体瘤中诱导有效的抗肿瘤免疫反应而且不引发全身毒性的方法或许是目前研究人员所面临的巨大挑战。
近日,一项刊登在国际杂志Nature Medicine上的研究报告中,癌症来自哥伦比亚大学的研究人员通过研究克服了上述问题,研究人员通过对一种非致病菌进行工程化修饰,使其能够在实体瘤中定植,并且能够安全地提供有效的免疫疗法,这种工程化改造的非致病菌或能扮演“特洛伊木马”来帮助抵御肿瘤。研究者指出,这种新型疗法不仅能够使淋巴瘤小鼠模型集体的肿瘤完全消退,还能够有效控制机体远端并未进行注射的肿瘤病变。
图片来源:Cell, 2019, doi:10.1016/j.cell.2019.07.019
doi:10.1016/j.cell.2019.07.019
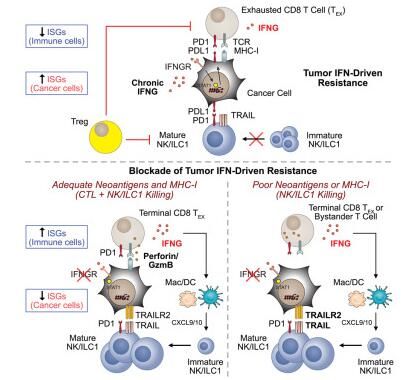
在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现一种能够告诉免疫系统抵抗癌症的关键信号通路也可被癌细胞用来抑制免疫系统。他们说,这种增加的理解可作为一种有助于预测哪些患者可能对免疫疗法作出反应的生物标志物。他们还展示了改变这种平衡如何对治疗本身产生潜在影响,这是因为在多种临床前癌症模型中,阻断癌细胞中的这种信号有助于免疫细胞抵抗肿瘤,相关研究结果发表在Cell期刊上。
研究重点关注干扰素(IFN)信号通路。干扰素通常有助于激活免疫系统来保护细胞免受病毒入侵,并因此得名,这是因为它们实际上干扰了病毒的传播能力。然而,干扰素也会抑制免疫系统。研究者Andy J. Minn博士说道,这种自相矛盾的影响已出现在诸如慢性病毒感染之类的其他疾病中,但是我们的研究展示了癌细胞如何利用干扰素的抑制特性干扰癌症免疫疗法。
【7】Nature:重大发现!靶向铁死亡有望增强免疫疗法的疗效
doi:10.1038/s41586-019-1170-y
在一项新的研究中,来自美国密歇根大学和Cayman Chemical公司的研究人员研究了一种鲜为人知的细胞死亡类型,即铁死亡(ferroptosis)。他们发现铁死亡在肿瘤细胞中发生,并且在癌症免疫中发挥作用,这些发现表明靶向这一途径有潜力让最热门的癌症治疗---免疫疗法---更加有效。相关研究结果发表在Nature期刊上。
研究者表示,“铁死亡之前已被定义,但是人们并不知道它与癌细胞死亡或免疫细胞有关。这将为科学家们探索开辟了一个巨大的窗口。这些研究人员发现当免疫疗法增强T细胞的活性时,这会增加肿瘤细胞中的氧化脂质水平,从而导致铁死亡。基于对小鼠和人癌细胞的研究,增加的铁死亡会让免疫疗法更有效地杀死癌症。
【8】Nature重磅:预先抑制TNF显著增强PD-1和CTLA-4联合免疫疗法疗效并降低副作用
doi:10.1038/s41586-019-1162-y
由Cima和纳瓦拉临床大学的研究人员领导的一项合作实验研究提出了一种治疗癌症的新方法,即在动物模型中使用联合免疫疗法解决疗效和毒性的问题。这种临床策略包括阻断一种参与免疫系统调节的蛋白(称为肿瘤坏死因子,TNF),同时联合免疫治疗(抑制PD-1和CTLA-4等其他“减缓”免疫反应的蛋白),相关研究成果于近日发表在Natrue杂志上。
研究者表示,在这项研究中,我们发现肿瘤坏死因子的免疫调节功能是可有可无的,甚至在某种程度上对这种联合免疫疗法有害。我们已经在这些动物模型中证实,免疫治疗前预防性阻断TNF可以避免不良反应,提高治疗反应。这使我们能够更好地调整药物的剂量,从而达到更强的抗肿瘤效果。
【9】Nature:中美合作揭示增强抗肿瘤反应新方法,可让癌症对免疫疗法的反应率提高至将近100%
doi:10.1038/s41586-019-0916-x
癌症免疫疗法---一种让免疫系统识别和杀死癌细胞的方法---已彻底改变了对许多癌症类型的治疗。比如,大约40%的黑色素瘤患者对免疫疗法作出反应,从而能够让免疫系统中的T细胞能够攻击癌细胞和控制疾病。在一项新的研究中,来自中国科学院等机构的研究人员以小鼠为研究对象,证实他们能够通过启动一条平行的途径,将肿瘤控制率由大约40%提高到将近100%,相关研究结果发表在Nature期刊上。
这项新的研究依赖于操纵树突细胞,其中树突细胞是免疫系统的重要组成部分,它们的主要功能是加工抗原,并将它们呈递给T细胞,此外,它们起着信使的作用,将先天性免疫系统和适应性免疫系统连接在一起。然而,一种称为YTHDF1的蛋白影响树突细胞对抗原的加工。这种蛋白是何川博士在2015年发现和鉴定出的。YTHDF1控制着破坏潜在肿瘤抗原的蛋白酶水平。这限制了将它们呈递给T细胞。这种限制是一个问题。不过,当这些研究人员清除了树突细胞中的YTHDF1时,这些细胞增强了它们吞噬抗原肽的能力,降解它们并将它们呈递给T细胞。这就为对免疫检查点抑制剂反应不佳的患者开辟了一种新的潜在有效的癌症治疗方法。
【10】Science子刊:增加胶原蛋白亲和力可改善癌症免疫疗法
doi:10.1126/scitranslmed.aau3259
基于免疫检查点抑制剂(CPI)和白细胞介素-2(IL-2)的癌症免疫疗法正变得越来越普遍,这是因为它们具有令人印象深刻的激活患者自身免疫系统以对抗肿瘤的能力。然而,全身性的免疫系统激活方法不是没有风险的,免疫疗法通常伴随着严重不良事件。
为了解决这个问题,在一项新的研究中,来自美国芝加哥大学、瑞士洛桑理工学院和日本东京大学的研究人员鉴于肿瘤血管系统的渗漏使得肿瘤基质胶原蛋白暴露于血液成分中,通过偶联(针对抗体)或重组融合(针对细胞因子)与源自血液蛋白VWF(von Willebrand factor)A3结构域的胶原蛋白结合结构域(CBD)结合在一起,让免疫检查点抑制剂(CPI)---抗CTLA4抗体(αCTLA4)+抗PD-L1抗体(αPD-L1)---和细胞因子IL-2靶向肿瘤,从而在局部发挥作用,相关研究结果近期发表在Science Translational Medicine杂志上。(生物谷Bioon.com)
生物谷2019年终盘点正在进行!更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


