多篇重要研究成果解读科学家们在癌症对疗法耐受性研究领域取得的新进展!
来源:生物谷原创 2023-07-31 09:24
本文中,小编整理了多篇重要研究成果,共同解读科学家们在癌症对疗法耐受性研究领域取得的新进展,分享给大家!
本文中,小编整理了多篇重要研究成果,共同解读科学家们在癌症对疗法耐受性研究领域取得的新进展,分享给大家!
【1】JCI:科学家识别出肺癌对药物疗法索托拉西布产生耐受性的分子机制
doi:10.1172/JCI164413
据西班牙肿瘤医学学会(SEOM)最新公布的数据显示,2023年西班牙将会有3万多例新发肺癌病例,这或许就使肺癌成为西班牙人群第二大常见的癌症类型,除了其较高的发病率外,这类癌症患者的5年生存率也是所有癌症类型中最低的一种,实际上,肺癌是迄今为止最致死的癌症类型,仅在2021年其就引发了超过2.2万名患者死亡。
近日,一篇发表在国际杂志Journal of Clinical Investigation上题为“Kras oncogene ablation prevents resistance in advanced lung adenocarcinoma”的研究报告中,来自西班牙国家癌症研究中心等机构的科学家们通过研究识别出了导致肺癌对索托拉西布(sotorasib)疗法产生耐受性的分子机制。针对每种肿瘤的特定生物学特性的个体化疗法是近几十年来癌症研究取得的巨大进步之一,其成功的原因是这种疗法能专门作用于参与癌细胞生长和生存的基因和蛋白质;鉴于KRAS基因在四分之一的肺癌中都处于突变的状态,因此针对这种突变基因的个体化疗法或许将会是肺癌患者治疗的一个巨大的突破口。
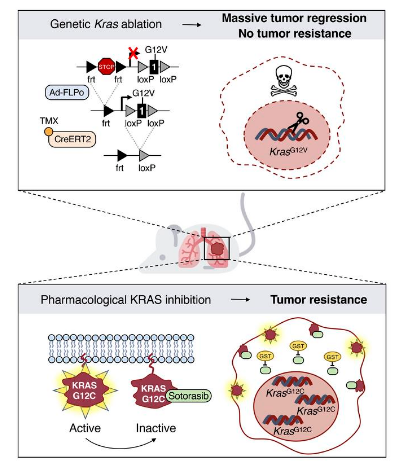
科学家识别出肺癌对药物疗法索托拉西布产生耐受性的分子机制。
图片来源:Journal of Clinical Investigation (2023). DOI:10.1172/JCI164413
实际上,2021年是治疗肺癌疗法的重要一年,因为首个针对肺癌中最常见的KRAS突变(吸烟所直接导致的结果)的个体化药物索托拉西布在美国获批,具体而言,索托拉西布能抑制突变的KRASG12C的异构体,在西班牙,每年大约有3000名新诊断的肺癌患者能因该疗法而获益。然而,大多数的患者很快会对该药物产生耐受性,而且疗法会变得不再有效,为此研究人员就想通过研究阐明肺癌对药物索托拉西布的耐药性是如何产生的,以便他们能开发出更好的预防性策略。
【2】Cancer Discov:识别出一种能预防癌症对疗法产生耐受性的新型策略
doi:10.1158/2159-8290.CD-22-0787
阻断癌症基因组不稳定性或能防止肿瘤多样化以及对疗法的逃逸;近日,一篇发表在国际杂志Cancer Discovery上题为“Blocking genomic instability prevents acquired resistance to MAPK inhibitor therapy in melanoma”的研究报告中,来自加利福尼亚大学等机构的科学家们通过进行一项新型临床及临床前研究,识别出了癌症对靶向性疗法耐受的DNA根源,这或许就有望为科学家们解决在癌症治疗过程中的棘手问题提供新的策略。
研究者Roger Lo说道,我们采用了一种新方法来对抗癌症的“获得性疗法耐受性”(acquired therapy resistance),即癌症通过进行分子进化来躲避靶向性疗法的能力;如今大量研究都集中于研究治疗癌症复发的疗法,从而在肿瘤细胞变得更加复杂和强大之后及时进行干预,研究者认为,预防而不是在癌症变得更具侵袭性后尝试逆转其耐受性或许会提高患者的生存几率。为了理解癌症基因组如何在启动靶向性疗法后立刻发生变化(可能会产生能逃避疗法的新型遗传突变),研究人员重点研究了转移性的皮肤黑色素瘤,这种侵袭性的皮肤癌目前并没有有效的疗法,直到最近科学家们开发出了一种针对癌症中携带BRAF基因突变的患者的靶向性疗法,BRAF突变在近乎一半的转移性黑色素瘤患者以及许多其它类型的常见和高致命性癌症患者中都存在。
【3】Mol Cell:靶向作用失控的炎症或有望开发出治疗对疗法耐受性的癌症的新型疗法
doi:10.1016/j.molcel.2023.04.017
炎症的失调是驱动携带肝脏激酶B1(LKB1)突变的肿瘤进展的关键特征,但连接LKB1突变与炎症失调的机制,目前研究人员并不清楚。近日,一篇发表在国际杂志Molecular Cell上题为“LKB1 controls inflammatory potential through CRTC2-dependent histone acetylation”的研究报告中,来自Van Andel研究所等机构的科学家们通过研究揭示了特定的基因突变是如何诱发炎性级联反应,从而驱动对疗法耐受的癌症发生的。
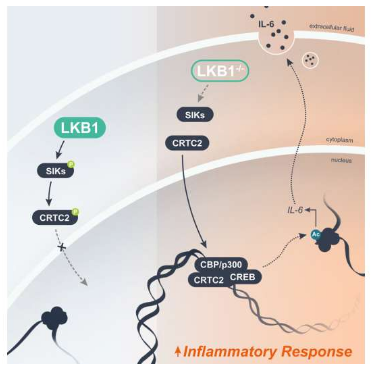
靶向作用失控的炎症或有望开发出治疗对疗法耐受性的癌症的新型疗法。
图片来源:Molecular Cell (2023). DOI:10.1016/j.molcel.2023.04.017
这篇研究报告中,研究人员首次揭示了STK11基因突变导致炎症失控的分子回路,由此所产生的化学风暴或会损伤健康细胞并促进癌症的发生,失去STK11基因的肿瘤很难治疗,因为其会对传统的化疗和很多最新的免疫疗法耐受。研究者Russell Jones说道,理解这种突变诱发癌症的机制和原因对于开发新型改进型疗法至关重要,而且本文研究中我们也识别出了这些癌症发生的重要特征,并表明,靶向作用炎症或许会使得这种肿瘤对疗法更有反应。
当基因所编码的指令被阻断时就会导致STK11突变,从而促使基因产生的LKB1蛋白的水平不足,LKB1是一种能维持细胞生长受到控制的肿瘤抑制子,LKB1的缺失会使得关键的细胞检查和平衡脱轨,并使得癌变细胞不受阻碍地生长。LKB1的突变是人类多种癌症中最常见的基因突变之一,尤其是对疗法耐受的肺癌、胰腺癌和宫颈癌等,同时其也是罕见疾病Peutz-Jeghers综合征的主要参与者,Peutz-Jeghers综合征患者通常会在其消化道中出现息肉,且患者的患癌风险会明显增加。
【4】Sci Transl Med:科学家识别出能克服三阴性乳腺癌对疗法耐受性的新型潜在靶点
doi:10.1126/scitranslmed.abl4414
自然杀伤性细胞(NK cells)是一种细胞毒性淋巴细胞,其会在肿瘤微环境中积累,通常被认为具有一定的抗肿瘤特性。近日,一篇发表在国际杂志Science Translational Medicine上题为“Immature natural killer cells promote progression of triple-negative breast cancer”的研究报告中,来自迈阿密大学米勒医学院等机构的科学家们通过研究发现,不成熟的自然杀伤性细胞或许存在于三阴性乳腺癌患者机体中,并且可能会促进(并非抑制)这种类型癌症的进展。相关研究结果或有望帮助研究人员通过确定特定的NK细胞作为潜在的治疗性靶点,从而抵御三阴性乳腺癌(一种最具侵袭性的乳腺肿瘤)患者对疗法的耐受性。
NK细胞通常被认为是机体抗肿瘤免疫反应的有效促进者,然而,并非所有的NK细胞都是平等的,研究者表示,不成熟的NK细胞或许存在于三阴性乳腺癌患者的组织样本中,且与这一类患者亚群的疾病预后较差有关。乳腺癌是一种最常被诊断的人类癌症,其目前仍然是引发美国女性癌症相关死亡的第二大原因,仅在2020年就有大约27.5万多例新发病例。三阴性乳腺癌在所有乳腺癌中占到了10%-15%的病例,其主要特点为缺失雌激素和孕激素受体,以及名为人类表皮生长因子(HER2)的特殊蛋白;相比其它类型的乳腺癌而言,三阴性乳腺癌患者有着较高的癌症复发率和转移率,而且由于缺少激素受体和HER2蛋白作为治疗性靶点,目前并没有有效的疗法来治疗这类乳腺癌患者。
【5】PNAS:科学家揭示乳腺癌对靶向性疗法产生耐受性的分子机制
doi:10.1073/pnas.220921111
大约四分之一的复发性雌激素受体阳性(ER+)的乳腺癌都缺少ER的表达,这就会使其对内分泌疗法产生一定的耐受性并会失控生长。近日,一篇发表在国际杂志Proceedings of the National Academy of Sciences上题为“14-3-3τ drives estrogen receptor loss via ERα36 induction and GATA3 inhibition in breast cancer”的研究报告中,来自贝勒医学院等机构的科学家们通过研究揭示了癌细胞是如何失去雌激素受体的,同时研究人员还揭示了一种特殊机制,其不仅能帮助解释上述过程还能提供克服这一过程的新型策略。
研究者Weei-Chin Lin教授说道,多年来我们的研究目标一直是阐明乳腺癌进展的复杂谜题,从而帮助理解其中的参与者是如何发生相互作用来赋予癌细胞对疗法耐受性以及持续性的生长的;我们旨在克服这一障碍并在这些癌症中恢复雌激素受体的表达以便其能对疗法再次易感,从而就能给患者一个更好的恢复机会。此前研究人员发现,名为14-3-3τ和ERα36两种细胞蛋白主要参与到了乳腺癌对内分泌疗法的耐受性发生过程中。
通过对携带人类雌激素受体阳性乳腺癌的小鼠模型进行研究,研究人员惊讶地发现,过表达这些肿瘤中的14-3-3τ或许会导致所有癌细胞变得雌激素受体阴性(ER-),研究者Lin说道,我仍然记得当我看到研究数据的那一天,其变化是具有戏剧性的,所有肿瘤竟然都失去了雌激素受体。在动物模型中研究其中的机制是非常耗时且耗力,为此研究人员开发了一种替代模型,这种人类乳腺癌细胞球体模型能更好地模拟从ER+到ER-的过渡过程,或许为未来科学家们进一步研究调查提供了非常有用的实验工具。
【6】Nat Commun:科学家有望克服乳腺癌对疗法耐受性发生的分子机制
doi:10.1038/s41467-022-32782-3
HER2+乳腺癌的肿瘤周围的微环境或能保护肿瘤并帮助其对广泛使用的疗法—单克隆抗体曲妥珠单抗产生耐受性,而且肿瘤微环境中名为成纤维细胞的特殊类型细胞在这一过程中扮演着关键角色,这些细胞能阻断免疫系统的功能并保护肿瘤,而找到一种能克服这种情况的方法或能增强新型疗法杀灭肿瘤细胞的能力。具体而言,正是TGF-β-激活的成纤维细胞的存在,才会表达名为FAP的分子,从而保护肿瘤免于免疫细胞的作用,药物曲妥珠单抗能靶向作用表达高水平HER2蛋白的癌细胞,而且当其与癌症结合时还能激活机体强烈的免疫反应,其是抵御肿瘤疗效的主要贡献者。
然而,在很多肿瘤中,免疫系统无法突破肿瘤周围的微环境来消灭癌症,这就会导致癌症对疗法耐受性的产生并增加癌症躲避药物且进一步增殖的能力。近日,一篇发表在国际杂志Nature Communications上题为“Targeted immunotherapy against distinct cancer-associated fibroblasts overcomes treatment resistance in refractory HER2+ breast tumors”的研究报告中,来自西班牙癌症网络生物医学研究中心等机构的科学家们通过研究就揭示了引发上述过程背后的分子机制。
科学家有望克服乳腺癌对疗法耐受性发生的分子机制。
图片来源:Nature Communications (2022). DOI:10.1038/s41467-022-32782-3
文章中,研究人员识别出了一种新方法或能克服肿瘤保护自身以及允许免疫系统对肿瘤细胞作用的方式,利用一种体外模型(这种模型包括来自乳腺癌患者机体的活细胞)进行研究,研究者发现,通过利用免疫疗法来靶向作用成纤维细胞所表达的FAP分子,这种组织免疫细胞进入的能力或许就会被逆转。Alexandre Calon博士说道,当FAP-IL2v分子被加入到包含这种疗法耐受性微环境的体外重建肿瘤中,当与免疫细胞接触后曲妥珠单抗的效力就会被恢复;应该指出的是,研究者所开发的模型能利用人类细胞,同样也适用于其它类型的肿瘤。
【7】Nat Commun:全基因组CRISPR筛选或能识别出前列腺癌中PARP抑制剂的敏感性和耐受性
doi:10.1038/s41467-023-35880-y
携带BRCA1/2突变的前列腺肿瘤对PARP抑制剂往往会异常敏感,而其它DNA损伤反应(DDR,DNA damage response)基因所发生的改变则反应较差;为了识别出此前哪些未知基因的缺失会对PARP抑制剂反应产生深远的影响,近日,一篇发表在国际杂志Nature Communications上题为“CRISPR screens reveal genetic determinants of PARP inhibitor sensitivity and resistance in prostate cancer”的研究报告中,来自Dana-Farber Brigham癌症研究中心等机构的科学家们通过进行一项多国联合研究,实现了全基因组CRISPR-Cas9的敲除筛选,目的是在BRCA1/2缺失肿瘤之外为使用PARP抑制剂提供信息,并支持对目前前列腺癌中PARP抑制的生物标志物进行重新评估。

全基因组CRISPR筛选或能识别出前列腺癌中PARP抑制剂的敏感性和耐受性。
图片来源:Nature Communications (2023). DOI:10.1038/s41467-023-35880-y
文章中,研究人员在前列腺癌中识别出了多个经常会被剔除的新基因(比如MMS22L和RNASEH2B),这些基因能充当前列腺癌中PARP抑制剂反应的预测性生物标志物。研究人员还发现,CHEK2(FDA批准的奥拉帕尼治疗反应的生物标志物)的缺失会介导对PARP抑制的耐受性,而并不是敏感性。
研究者表示,包括PARP抑制剂在内的当前靶向性癌症疗法主要是以单一基因的突变而指导,忽略了同时所发生的基因组改变。他们发现,PARP抑制剂的敏感性反而依赖于多个基因组改变之间的相互作用,因此,进行全面的基因组分析或许能帮助改善对患者的临床决策。
【8】Gastroenterology:饮食改变或会饿死结直肠癌细胞并帮助克服癌症的疗法耐受性
doi:10.1053/j.gastro.2022.11.014
结直肠癌(CRC)是一种毁灭性的疾病,其能被膳食营养高度调节,mTORC1会促进肿瘤生长并限制疗法反应,而生长因子信号是mTORC1激活的一种主要机制。近日,一篇发表在国际杂志Gastroenterology上题为“Dysregulated amino acid sensing drives colorectal cancer growth and metabolic reprogramming leading to chemoresistance”的研究报告中,来自密歇根大学等机构的科学家们通过研究发现,饮食的改变或许是增强结直肠癌疗法的关键。
癌细胞需要营养物质来生存和生长,细胞中最重要的营养感知分子之一就是mTORC1,其通常被称为细胞生长的主要调节子,能促进细胞感知不同的营养物质从而生长和增殖,当营养物质有限时,细胞就会调低营养感知级联程序并关闭mTORC1。尽管mTORC1已知在结肠癌中会过度活跃,但关键的问题在于结肠肿瘤是否会劫持营养感知通路来启动这个主要的调节子。
研究者Yatrik M. Shah博士表示,在结肠癌中,当减少肿瘤中可用的营养物质时,细胞就不知道该做什么了,没有营养物质来生长,细胞就会经历危机,从而导致大量细胞死亡。研究者在细胞和小鼠机体中发现,低蛋白饮食会阻断启动癌症生长主要调节子的营养信号通路,mTORC1调节子能控制细胞利用营养信号来生长和繁殖的方式,其会在携带特定突变的癌症中高度活跃,且已知其会促使癌症使其对当前疗法耐受,低蛋白饮食,尤其是减少两种关键氨基酸的饮食模式或许会通过一种名为GATOR的复合体来改变营养信号。
GATOR1和GATOR2能互相协作来维持mTORC1的运作模式,当细胞中有充足的营养物质时,GATOR2就会激活mTORC1,而当营养物质不足时,GATOR1则会使得mTORC1失活,限制某些氨基酸或许就会阻断营养物质的信号。此前阻断mTORC的研究主要集中在抑制促癌信号上,但这些抑制剂会引发明显的副作用,当患者停止服药后癌症就会复发,本文研究结果表明,通过低蛋白饮食来限制氨基酸的摄入从而阻断营养物质通路或许能提供一种关闭mTORC的替代方法。
【9】Mol Cell Proteomics:科学家识别出了药物吉西他滨耐受性产生的关键代谢调节子 有望帮助抵御人类胰腺癌
doi:10.1016/j.mcpro.2022.100409
胰腺导管腺癌(PDAC)是一种高度难治的疾病,标准护理治疗药物吉西他滨(gemcitabine)仅能够给患者提供适度的生存益处,而对该药物抗性的产生往往损害了其疗效。近日,一篇发表在国际杂志Molecular & Cellular Proteomics上题为“Comparative Proteomic Analysis Identifies Key Metabolic Regulators of Gemcitabine Resistance in Pancreatic Cancer”的研究报告中,来自Roswell Park综合癌症研究中心等机构的科学家们通过研究识别出了参与癌细胞对药物吉西他滨耐药的关键代谢调节子,吉西他滨是一种用于治疗PDAC的标准化疗手段。
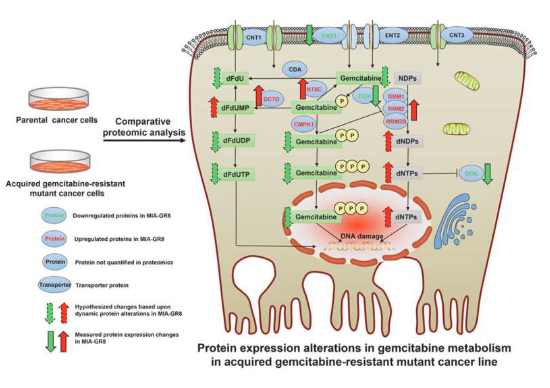
科学家识别出了药物吉西他滨耐受性产生的关键代谢调节子 有望帮助抵御人类胰腺癌。
图片来源:Molecular & Cellular Proteomics (2022). DOI:10.1016/j.mcpro.2022.100409
癌细胞对药物吉西他滨的耐受性往往会在临床化疗治疗期间产生,从而导致患者预后不良,而理解癌细胞对吉西他滨所产生耐药性背后的分子机制对于科学家们而言一直是一大挑战。这项研究中,研究人员利用了一种先进的全面定量蛋白质组分析手段识别出了PDAC对吉西他滨耐药性产生的关键代谢调节子,研究人员系统性地分析了PDAC癌细胞并识别出了多个药物耐受性治疗性弱点,其或能作为靶点来帮助改善经历吉西他滨耐药性的PDAC患者的治疗结局。
PDAC并不会对当前的疗法或一些在其它癌症治疗过程中表现良好的新型免疫疗法产生反应,而吉西他滨是PDAC患者治疗的主要药物,且其仅能给患者提供适度的生存效益,在临床上,吉西他滨耐药性的产生非常快,而且还会影响患者的治疗效果。为此,这项研究中,研究人员开发出了多个能获得高度吉西他滨耐药性的癌细胞系。随后研究人员利用较为详细的蛋白质组分析检测了他们提出的假设,即所开发的细胞系中对吉西他滨敏感性的较大的缺失或许能帮助确定PDAC细胞中能一起合作共同创造高度耐药状态的多种蛋白质功能网络。
【10】Nat Commun:揭示胰腺癌利用特殊蛋白来对疗法耐受的分子机制
doi:10.1038/s41467-023-35796-7
胰腺癌是美国第三大致命的癌症类型,其仅次于肺癌和结直肠癌,尽管其并不常见,但其仍然是最难有效治疗的癌症之一,因为胰腺癌干细胞会对常规和靶向性疗法快速产生耐受性,比如化疗和新型的癌症免疫疗法,因此,胰腺癌患者的5年生存率仅为10%左右。近日,一篇发表在国际杂志Nature Communications上题为“Smarcd3 is an epigenetic modulator of the metabolic landscape in pancreatic ductal adenocarcinoma”的研究报告中,来自加利福尼亚大学等机构的科学家们通过研究揭示了胰腺癌细胞如何通过利用一组特殊蛋白来抵御疗法的攻击,这组特殊蛋白通常会抑制肿瘤从而帮助癌细胞躲避疗法并快速生长。
此前研究结果表明,胰腺癌对疗法的耐受性是由其对常规制剂的不同反应所引起的,而肿瘤细胞的异质性(多样性),尤其是促进对疗法耐受性的干细胞特征会促进这种反应。这项研究中,研究人员调查了转变表观基因组学(告诉基因组应该做什么的众多蛋白)而不是基因组的变化(具体到基因本身)是如何驱动癌细胞耐受性发生的。
研究者Reya说道,胰腺癌干细胞是一种恶性的癌细胞,其能抵御常规疗法并驱动肿瘤复发,这类干细胞依赖于表观遗传调节机制来保护自身并促进癌症的生存和生长。于是我们就想通过研究来识别出癌症干细胞所使用的基本工具和机制,从而更好地理解癌症对疗法耐受性背后的机制,或许如何规避癌细胞的耐受性。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


