点石成'基' | RET'燃'起靶药治疗新纪元
来源:生物谷 2021-03-26 09:42
2021年3月24日,国家药品监督管理局(NMPA)通过优先审评审批程序附条件批准受体酪氨酸激酶RET(Rearranged during Transfection)抑制剂普拉替尼胶囊(pralsetinib,商品名:普吉华)上市,用于既往接受过含铂化疗的转染重排(RET)基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。该药品上市为局
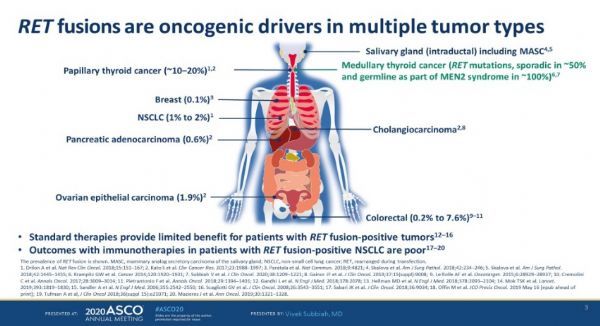
[1] T Kohno, et al. Transl Lung Cancer Res. 2015 Apr;4(2):156-64.
[2] Vivek Subbiah, 2020 ASCO
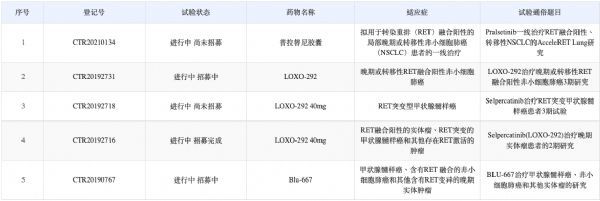
RET的异常激活主要有三种机制包括RET基因融合,RET基因定向突变和RET基因过表达。根据中国国家药监局药品审评中心(CDE)网站最新数据显示,RET靶向抑制剂已在中国获得5项临床试验默示许可,适应症为:RET融合阳性NSCLC、RET融合阳性的实体瘤、RET 突变的MTC和其他存在RET激活的肿瘤。
中国国家药监局药品审评中心(CDE)网站
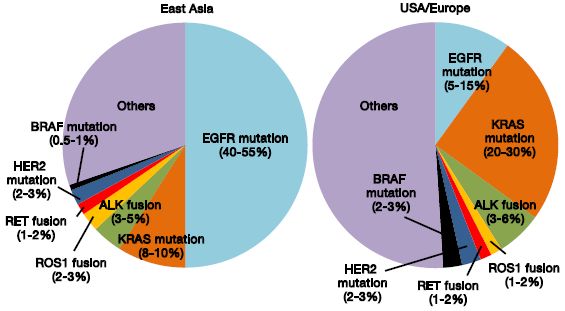
RET基因最常见的断裂位点位于内含子11,至今已发现至少50余种RET融合变体,其中以KIF5B-RET和CCDC6-RET最为常见。在众多伴随诊断的技术平台中,相比于传统检测方法,二代基因测序(NGS)具有高通量、高灵活性的特点,能够同步检测多个基因、不同形式及未知突变,尤其对于平行检测和鉴别有可及药物的罕见驱动基因变异,具有明显的优势。CSCO NSCLC诊疗指南(2020)推荐通过NGS方法确定包括RET融合在内的具有临床意义的目标靶点[3],检测的精准可靠对于鉴别患者肿瘤携带的基因变异和作为药物的伴随诊断至关重要。
CDx已成为精准医疗重要里程碑
根据今年3月1日开始实施「抗肿瘤药物临床应用管理办法」第二十三条:国家卫生健康委发布的诊疗规范、临床诊疗指南、临床路径或药品说明书规定需进行基因靶点检测的靶向药物,使用前需经靶点基因检测,确认患者适用后方可开具。加强对肿瘤细胞耐药发生机制及其对策的研究,针对不同耐药机制采取相应的应对策略,增加患者获益可能。
在患病人群检测领域,燃石医学始终致力于打造国际一流的NGS检测技术。 2018年获美国食品药品监督管理局(简称"FDA")邀请,参与由FDA发起的二代测序质量控制SEQC2研究,包含组织和血液样本测试,燃石医学在该研究中取得了优异的成绩。FDA SEQC2工作组组织了研究数据的分析和发表,相关文章已被Nature Biotechnology杂志接收。
生物标志物检测和伴随诊断开发是精准肿瘤药物临床开发必不可少的伙伴。燃石医学将基于全球领先的NGS检测技术,开发普拉替尼在中国地区的伴随诊断产品,检测肿瘤患者的RET基因变异,鉴别可用药人群。
[1] T Kohno, et al. Transl Lung Cancer Res. 2015 Apr;4(2):156-64.
[2] Vivek Subbiah, 2020 ASCO
[3] 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南2020
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。