Mol Cell:科学家揭示治疗遗传性肝脏疾病的潜在治疗性靶点
来源:本站原创 2022-01-07 11:26
来自美国西北大学Feinberg医学院等机构的科学家们通过研究发现了能增加机体严重肝脏几块冰风险的罕见遗传突变背后的分子机制,相关研究结果或有望帮助开发治疗肝脏疾病的新型疗法。
2022年1月7日 讯 /生物谷BIOON/ --内质网腔内未折叠或错误折叠的蛋白质的积累或会诱发未折叠蛋白反应(UPR,unfolded protein response)来适应压力,如果该过程失败的话就会诱发细胞凋亡和组织/器官的损伤,目前研究人员并不清楚UPR如何选择压力适应而不是细胞凋亡背后的分子开关。近日,一篇发表在国际杂志Molecular Cell上题为“HRD1-mediated METTL14 degradation regulates m6A mRNA modification to suppress ER proteotoxic liver disease”的研究报告中,来自美国西北大学Feinberg医学院等机构的科学家们通过研究发现了能增加机体严重肝脏几块冰风险的罕见遗传突变背后的分子机制,相关研究结果或有望帮助开发治疗肝脏疾病的新型疗法。
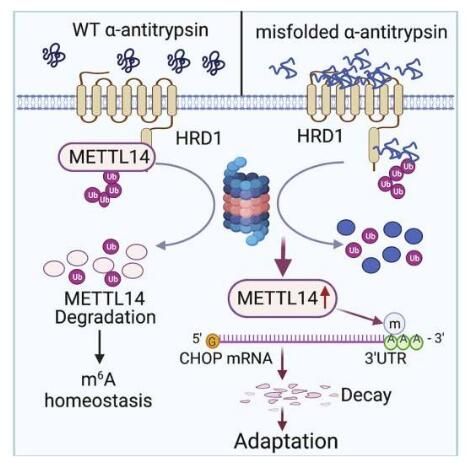
图解摘要。
图片来源:DOI:10.1016/j.molcel.2021.10.028
α-1抗胰蛋白酶(AAT,Alpha-1 antitrypsin)缺乏是一种罕见的遗传突变,其会增加机体患多种疾病的风险,包括严重肝脏疾病,在美国大约3500人中就有1人会被诊断为患有这种遗传性疾病;AAT蛋白是由肝脏制造并能进入血液中来保护肝脏和其它器官免于感染;然而AAT缺乏却会导致血液中较低水平的AAT,以及其在肝脏中的积累,从而就会危及个体生命。
AAT的缺乏往往是由丝氨酸蛋白酶抑制剂1A基因(SERPINA1)的突变所引起,该基因能产生AAT;在分子层面上,该基因的突变会导致毒性未折叠蛋白在肝细胞的内质网中积累,并会触发一种用于压力反应适应的未折叠蛋白反应。这些未折叠的蛋白反应对于通过停止蛋白质的翻译来恢复细胞的正常功能、降解错误折叠的蛋白质以及激活有益的细胞信号通路非常必要;然而未折叠蛋白反应的失败却会诱发细胞凋亡,并会损伤周围的器官活组织,比如肝脏等。
决定这种未折叠蛋白反应如何选择压力适应而并不是细胞凋亡的分子机制,目前研究人员尚不清楚;在当前研究中,研究者Fang及其同事利用免疫荧光法来研究AAT诱导的肝脏疾病的小鼠模型机体中的肝脏细胞系。结果发现,在小鼠模型中,未折叠的蛋白质的积累会上调代谢酶类METTL14(代谢酶N6-腺苷甲基转移酶-14,N6-adenosine-methyltransferase-14)的表达,METTL14还会抑制C/EBP-同源(CHOP)蛋白质诱导的内质网压力适应的细胞凋亡。
图片来源:https://www.cell.com/molecular-cell/fulltext/S1097-2765(21)00948-5?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1097276521009485%3Fshowall%3Dtrue
研究者Fang说道,肝脏中METTL14被特异性剔除的小鼠往往对急性药理学和AAT缺失诱导的内质网蛋白毒性压力和肝脏损伤非常易感;随后研究人员将敲除了METTL14的小鼠模型与AAT诱导的肝脏疾病小鼠模型进行杂交,结果发现,基因敲除的小鼠模型仅仅能存活14周,这就表明,CHOP蛋白的剔除或能保护METTL14敲除的小鼠免于蛋白毒性肝脏损伤。
综上,本文研究结果揭示了内质网压力和mRNA m6A修饰通路(ERm6A通路)之间的串扰,这或许用于针对蛋白毒性的内质网压力适应机制。(生物谷Bioon.com)
原始出处:
Juncheng Wei,Bryan T. Harada,Dan Lu, et al. HRD1-mediated METTL14 degradation regulates m6A mRNA modification to suppress ER proteotoxic liver disease, Molecular Cell (2021). DOI:10.1016/j.molcel.2021.10.028
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



