2021年终盘点:细胞外囊泡重磅级研究成果解读
来源:本站原创 2021-01-02 18:21
时光匆匆,2021年已经接近尾声,迎接我们的将是崭新的2022年,2021年细胞外囊泡相关发表了很多重磅级的研究成果,本文中,小编就对本年度科学家们在该领域取得的重磅级研究成果进行整理,分享给大家!
时光匆匆,2021年已经接近尾声,迎接我们的将是崭新的2022年,2021年细胞外囊泡相关发表了很多重磅级的研究成果,本文中,小编就对本年度科学家们在该领域取得的重磅级研究成果进行整理,分享给大家!
图片来源:CC0 Public Domain
【1】Cell Metab: 肿瘤来源的外泌体通过糖酵解显性代谢重编程驱动转移前生态位的免疫抑制巨噬细胞。
doi:10.1016/j.cmet.2021.09.002
转移前生态位的定义特征之一是免疫抑制巨噬细胞的浸润,这是原发性肿瘤转移的基本要求。这些巨噬细胞是如何获得其表型的仍在很大程度上未被探索。近日,路易斯维尔大学医学院发表在Cell Metabolism杂志上的研究发现肿瘤来源的外泌体(TDEs)通过依赖NF-kb、糖酵解酶主导的代谢重编程,使巨噬细胞向免疫抑制表型极化,其特征是PD-L1表达增加。
TDE信号通路通过TLR2和NF-κB导致葡萄糖摄取增加。TDEs还刺激NOS2升高,抑制线粒体氧化磷酸化,导致丙酮酸向乳酸的转化增加。乳酸反馈NF-κB,进一步增加PD-L1。对非小细胞肺癌患者转移阴性淋巴结的分析显示,巨噬细胞PD-L1与原发肿瘤的GLUT-1和囊泡释放基因YKT6水平呈正相关。研究者指出巨噬细胞在转移前的生态位获得其免疫抑制表型,并确定了外泌体,代谢和转移之间的重要联系。
【2】Adv Mater: 设计富含棕榈酰ACE2的细胞外囊泡治疗COVID-19
doi:10.1002/adma.202103471
血管紧张素转换酶2 (Angiotensin转换酶2,ACE2)是存在于细胞表面的一种关键受体,可直接与严重急性呼吸综合征冠状病毒2
(SARS-CoV-2)的病毒刺突(S)蛋白相互作用。因此,抑制这种相互作用有望在治疗新冠肺炎中发挥重要作用。近日浙江大学研究者发表在Adv Mater杂志上的研究发现了细胞外囊泡(ev)中ACE2的存在,并通过蛋白质棕榈酰化来测定EV-ACE2的水平。
ACE2上的Cys141和Cys498残基被锌指DHHC-Type棕榈酰转移酶3 (ZDHHC3) s -棕榈酰化,并被酰基蛋白硫酯酶1 (LYPLA1)去棕榈酰化,这对ACE2的膜靶向和EV的分泌至关重要。研究者通过将s -棕榈酰化依赖的质膜(PM)靶向序列与ACE2融合,在其表面富集ACE2的ev(称为PM-ACE2- ev)被设计出来。结果表明,pm -ACE2- ev可与SARS-CoV-2 S-RBD高亲和力结合,并在体外阻断其与细胞表面ACE2的相互作用。
pm -ACE2- ev在人ACE2
(hACE2)转基因小鼠中表现出对伪型和真型SARS-CoV-2的中和作用,有效阻断真型SARS-CoV-2的病毒载量,从而保护宿主抵御SARS-CoV-2诱导的肺部炎症。研究者指出这是一种有前途的新型生物材料,用于预防和治疗COVID-19提供了一种有效的工程方案。
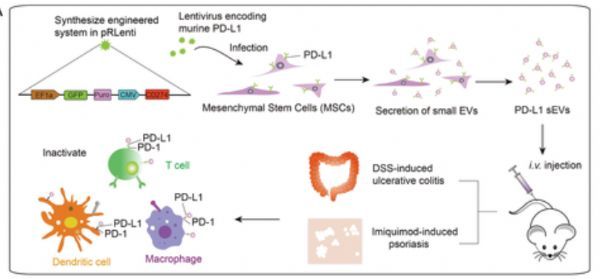
【3】Adv Mater: 高PD-L1表达的间充质干细胞来源的细胞外囊泡治疗自身免疫性疾病
doi:10.1002/adma.202106265
人体免疫系统不仅能抵御病原体,还能通过免疫监测来维持体内平衡,以控制由于环境损害引起的炎症。自身免疫性疾病是由于免疫系统失衡,干扰免疫耐受而引起的。自身免疫性疾病是影响许多患者生活质量的第三大常见疾病。
近日苏州大学研究人员发表在Adv Mater上的一篇文章研究者利用慢病毒介导的基因转染技术,开发了一种程序化细胞死亡配体1 + (PD-L1)间充质干细胞(MSC)衍生的细胞外囊泡(MSC- sevs -PD-L1),用于自身免疫性疾病中受影响组织的局部免疫微环境重构。MSC-sEVs-PD-L1在体外显示出一种令人印象深刻的能力,可以调节各种活化的免疫细胞到免疫抑制状态。
更重要的是,研究者发现在右旋糖酐硫酸钠诱导的溃疡性结肠炎(UC)和咪基莫德诱导的银屑病小鼠模型中,与PD-L1+ MSCs相比,在炎症组织中观察到MSC-sEVs-PD-L1显著高积累。研究者通过使用MSC-sEVs-PD-L1重塑局部免疫环境下的炎症生态系统,证实了UC和银屑病小鼠疾病模型的治疗效果。
图片来源: https://doi.org/10.1002/adma.202106265
【4】Cell: 免疫刺激RNA RN7SL1使CAR-T细胞增强自主和内源性免疫功能
doi:10.1016/j.cell.2021.08.004
肿瘤浸润不良、衰竭发展和抗原不足是限制嵌合抗原受体(CAR)-T细胞效能的常见机制。模式识别受体激动剂的传递是改善免疫功能的一种策略;然而,将这些激动剂靶向到免疫细胞是一项挑战,而在癌细胞中脱靶信号传导可能是有害的。近日Lexus
R.Johnson等人发表在Cell杂志上的研究中研究者设计了一种CAR-T细胞传递RN7SL1,一种内源性RNA,激活RIG-I/MDA5信号。
RN7SL1促进CAR-T细胞的扩展和效应记忆分化。此外,RN7SL1部署在细胞外囊泡,并选择性转移到免疫细胞。与其他RNA激动剂不同,转移的RN7SL1限制骨髓源性抑制细胞(MDSC)的发育,降低骨髓细胞中的TGFB,并培养具有共刺激特征的树突状细胞(DC)亚群。因此,内源性效应记忆和肿瘤特异性T细胞也扩大,允许排斥带有CAR抗原丢失的实体肿瘤。在内源性免疫的支持下,CAR- t细胞现在可以与RN7SL1共同部署肽抗原来增强疗效,即使异质性CAR抗原肿瘤缺乏足够的新抗原。
【5】Cell Metab: 来自能量应激脂肪细胞的线粒体的基于细胞外囊泡的器官间运输
doi:10.1016/j.cmet.2021.08.002
脂肪组织功能障碍是肥胖和2型糖尿病中代谢紊乱的首要问题。在肥胖的情况下,肥厚的脂肪细胞会功能失调,失去有益的内分泌功能,促进组织炎症和纤维化。肥胖时脂肪细胞经历强烈的能量应激,导致线粒体质量和功能的丧失。
研究者发现脂肪细胞通过快速而有力地释放小的细胞外囊泡(sev)来应对线粒体应激。这些sev包含有呼吸能力,但氧化损伤的线粒体颗粒,进入循环并被心肌细胞吸收,在那里它们触发了ROS的爆发。结果是心脏代偿性抗氧化信号,保护心肌细胞免受急性氧化应激,与预处理范式一致。研究者指出单次注射来自能量应激脂肪细胞的sev可以限制小鼠心脏缺血/再灌注损伤。因此,研究者最终揭示发现这些看似有毒的脂肪细胞sev可能提供了一种生理途径,对肥胖引起的不可避免的脂毒性或缺血性应激提供强有力的心脏保护。
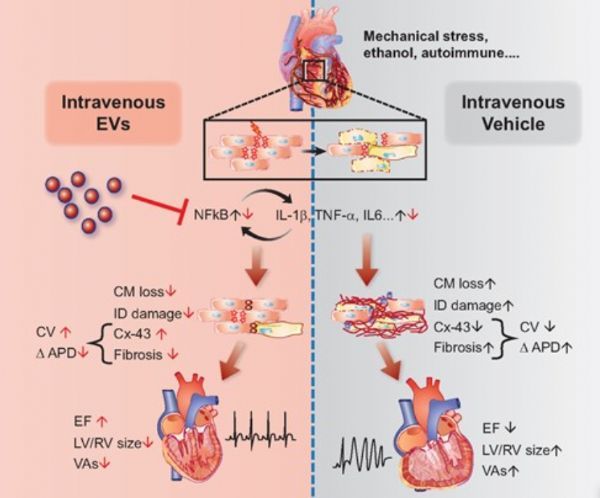
【6】Eur Heart J: 在desmoglein-2突变小鼠中,来自永生化的心脏源性细胞的细胞外囊泡可以减弱致心律失常的心肌病
doi:10.1093/eurheartj/ehab419
心律失常性心肌病(ACM)的特点是心肌细胞的逐渐丧失和纤维脂肪组织替代。由心球来源的细胞分泌的细胞外囊泡(ev),永生化,并被设计表达高水平的β-catenin,发挥抗炎和抗纤维化作用。近日发表在Eur Heart J杂志上的研究评估了ev在ACM小鼠模型中的疗效。
4周大的纯合子敲入突变desmoglein-2被随机分配到每周的电动汽车或车辆中,持续4周。4周后,给予ev的DSG2mt/mt小鼠双室功能改善,左室扩张减少。ev处理DSG2mt/mt小鼠的心电图显示QRS波时限缩短和QTc间隔缩短。EV组进一步的电生理测试显示负担减轻,室性心律失常的诱发性降低。光学映射显示接收ev的Dsg2mt/mt小鼠复极加速和传导加快。EV治疗后,DSG2mt/mt心脏纤维化减少,细胞死亡减少,连接蛋白43表达保持。
研究者发现Dsg2mt/mt小鼠的心脏明显表达了炎症细胞因子水平的升高,而这些细胞因子在一定程度上被EV治疗所减弱。泛炎症转录因子核因子-κB (NF-κB)、炎症小体传感器NLRP3和巨噬细胞标记物CD68在ev处理后均减少。在体外和体内阻断EV hsa-miR-4488可激活NF-κB并减弱EV的有益作用。
图片来源:
https://doi.org/10.1093/eurheartj/ehab419
【7】Eur Heart J: 脂质体介导血浆中SARS-CoV-2 rna阳性细胞外囊泡的检测
doi:10.1038/s41565-021-00939-8
血浆SARS-CoV-2 RNA可能是一种可行的替代诊断方法,而呼吸道RNA水平在感染后迅速下降。反转录定量PCR (RT-qPCR)参考试验在血浆中表现不理想,可能反映了释放到循环中的病毒RNA的稀释和降解,但这些问题可以通过分析包装到细胞外囊泡中的病毒RNA来解决。
近日,发表在Eur Heart J杂志上的一项研究描述了一种检测方法,将直接从血浆中捕获的细胞外囊泡与载药脂质体融合,以敏感地扩增和检测SARS-CoV-2基因靶标。该方法准确识别COVID-19患者,包括RT-qPCR遗漏的挑战性病例。在感染后第1天检测到sars - cov -2阳性的细胞外囊泡,在非人灵长类模型中,从第6天到第28天端点呈平稳状态,而在幼儿中观察到信号持续20-60天。这种纳米技术方法使用非传染性样本,并延长了病毒检测窗口,为在呼吸道中未检测到SARS-CoV-2 RNA的患者中支持COVID-19诊断提供了工具。
【8】Eur Heart J: 心肌缺氧应激介导功能性心肌细胞外囊泡释放
doi:10.1093/eurheartj/ehab247
细胞外囊泡(ev)的脱落增多,这是一种脂质双分子层限定的小颗粒,在旁分泌信号中发挥作用,与人类病理有关,如动脉粥样硬化,但这是否适用于心脏疾病尚不清楚。在European Heart Journal杂志上发表的研究发现了循环CD172a+
ev是心脏衍生的,显示了它们的释放和功能,并为主动脉狭窄患者的预后提供了证据。
在这里,研究者使用表面抗原CD172a作为心肌细胞(CM)衍生ev的特异性标记物;CD172a+
ev的CM起源由其心脏特异性蛋白和心脏富集microRNAs的含量支持。研究者发现主动脉狭窄、缺血性心脏病或心肌病患者的循环CD172a+心脏EV计数高于健康受试者。在体外和体内实验中,细胞应激是CMs释放EV的主要决定因素,缺氧增加了胞外分泌物的脱落。在功能层面,EVs孤立的上层清液的CMs来源于人为多能干细胞,在低氧的气氛中培养引起正性肌力反应轻CMs,影响发现依赖增加EV的数量表达神经酰胺表面。在潜在的临床意义上,心脏循环CD172a+ ev计数最高的主动脉瓣狭窄患者经导管主动脉瓣置换术的预后较低。
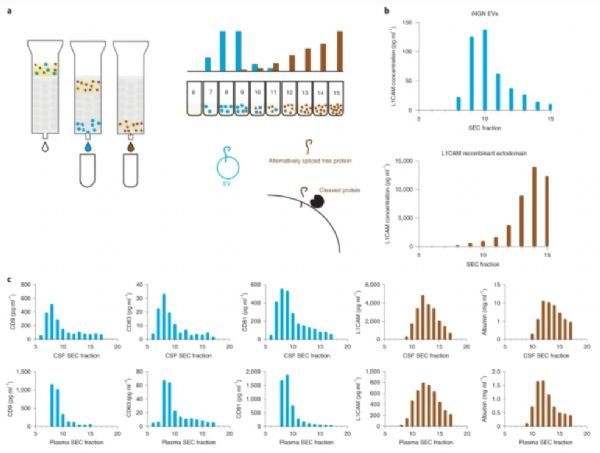
【9】Nat Methods: 心肌缺氧应激介导功能性心肌细胞外囊泡释放
doi:10.1038/s41592-021-01174-8
L1CAM是一种表达于神经元上的跨膜蛋白,被认为存在于人类体液中的神经元衍生的细胞外囊泡(NDEVs)上。近日,Nature Methods杂志上发表了该文章,研究者开发了一组单分子阵列分析来评估L1CAM在NDEV分离中的应用。研究者证明了L1CAM与人血浆或脑脊液中的细胞外囊泡无关,因此建议在NDEV分离协议中不要将其作为标记物使用。
图片来源: https://www.nature.com/articles/s41592-021-01174-8
【10】Nat Nanotechnol:
细胞外囊泡药物的使用可以实时监测肿瘤的靶向治疗
doi:10.1038/s41565-021-00872-w
目前测量药物-靶点相互作用的技术需要复杂的处理和侵入性组织活检,限制了它们在癌症治疗监测中的临床应用。在这里,研究者开发了一个分析平台,利用循环细胞外囊泡(ev)来评估患者血液样本中肿瘤特异性药物-靶标相互作用的活性。该技术被称为细胞外囊泡监测小分子化学占用和蛋白表达(ExoSCOPE),利用生物正交探针放大和匹配等离子体纳米环谐振器内分子反应的空间模式来实现EV药物动力学的原位分析。
它测量了ev分子亚群中药物占用和蛋白质组成的变化。当用于监测各种靶向治疗时,ExoSCOPE揭示了EV特征,密切反映了细胞治疗效果。研究者进一步将该技术应用于临床癌症诊断和治疗监测。使用少量血液,ExoSCOPE在治疗开始后24小时内准确分类疾病状态并快速区分靶向治疗结果。
【11】J Extracell Vesicles: 在npm1突变的急性髓细胞白血病中,肿瘤来源的细胞外小泡通过抑制slc6a8介导的肌酸导入抑制CD8+ T细胞免疫功能。
携带核磷蛋白(NPM1)突变的急性髓系白血病(AML)已被定义为急性白血病的一个独特实体。尽管在诊断和治疗方面有显著的进步,但长期的结果对这个实体仍然不满意。新出现的证据表明,白血病类似于其他恶性疾病,利用各种机制逃避免疫细胞的杀死。然而,npm1突变的AML的免疫逃逸机制仍不清楚。
近日在J Extracell Vesicles杂志上发表了文章揭示了在共培养系统中,npm1突变的AML患者的血清和白血病细胞均损害了CD8+ T细胞的免疫功能。研究者揭示了白血病细胞通过细胞外小泡(sev)将miR-19a-3p分泌到肿瘤微环境(TME)中,而sev是由npm1突变蛋白/ cctc结合因子(CTCF)/聚(A)结合蛋白细胞质1
(PABPC1)信号轴控制的。CD8+ T细胞内化sev相关的miR-19a-3p,直接抑制溶质载体家族6成员8的表达(SLC6A8;肌酸特异性转运体),以抑制肌酸的输入。
肌酸水平降低可减少ATP的产生,损害CD8+
T细胞的免疫功能,导致白血病细胞的免疫逃逸。该研究证明了白血病细胞来源的sev相关的miR-19a-3p通过靶向slc6a8介导的肌酸导入对CD8+ T细胞进行免疫抑制,提示sev相关的miR-19a-3p可能是治疗npm1突变的AML的一个有前景的治疗靶点。
【12】Nat Commun: GAPDH控制细胞外囊泡的生物发生,并提高EV介导的siRNA传递到大脑的治疗潜力
doi:10.1038/s41467-021-27056-3
细胞外囊泡(ev)是一种生物纳米颗粒,在细胞间通讯中发挥重要作用,并有潜力作为药物传递载体。Nature communication杂志近日发表文章证明了糖酵解酶甘油醛-3-磷酸脱氢酶(GAPDH)在EV组装和分泌中的作用。研究者观察到高水平的GAPDH通过磷脂酰丝氨酸结合基序(G58)与EV外表面结合,这促进了广泛的EV聚集。在果蝇EV生物发生模型的进一步研究表明,GAPDH是核内体室腔内囊泡正常生成所必需的,并促进囊泡聚集。
gapdh衍生的G58多肽与dsrna结合基序的融合使小干扰RNA (siRNA)高效加载到EV表面。在全身注射后,这种囊泡有效地将siRNA输送到亨廷顿病小鼠模型的大脑多个解剖区域,导致大脑不同区域的亨廷顿基因沉默。
【13】J Extracell
Vesicles: 通过εPL-PEG-DSPE逆转msc来源的细胞外小泡的表面电荷,增强骨关节炎治疗
doi:10.1002/jev2.12160
间充质干细胞来源的细胞外小泡(MSC-sEVs)在骨关节炎(OA)治疗中具有巨大的治疗潜力。然而,软骨基质的空间位阻和静电阻导致msc - sev在软骨中的分布非常有限,关节内注射后msc - sev的生物利用度很低。
近日,Kai Feng等人在J
Extracell Vesicles杂志上发表的一篇研究开发了一种新型阳离子两亲性大分子ε-聚赖氨酸-聚乙烯-二硬脂基磷脂酰乙醇胺(PPD)修饰MSC - SEV,从而逆转其表面电荷的策略。研究者发现通过与100 μg/ml PPD共孵育制得到带正电荷的MSC - SEV (PPD- SEV),改性过程对SEV的完整性和含量几乎没有干扰,在阴离子大分子干扰下表现出良好的稳定性。
与未修饰的MSC - SEV相比,PPD
- SEV对软骨细胞具有更有效的细胞摄取和内稳态调节能力。更重要的是,与MSC - SEV相比,PPD - SEV显示出软骨摄取、软骨穿透和关节保留能力显著增强。PPD - SEV关节内注射小鼠OA模型的生物利用度明显高于MSC - SEV,提高了治疗效果,减少了注射频率。
【14】Cell Metab: MiR-690,一种来自m2极化巨噬细胞的外泌体来源的miRNA,改善肥胖小鼠的胰岛素敏感性
doi:10.1016/j.cmet.2020.12.019
松弛素是一种抗纤维化肽激素,以前被认为可以直接逆转肝星状细胞的激活以解决肝纤维化。使用纳米颗粒介导的传递,加利福尼亚大学在Cell Metab发表的杂志中研究人员发现,尽管松弛素基因治疗可以在体内减少肝纤维化,但在体外治疗不能诱导激活的肝星状细胞的静止。
研究者发现肝巨噬细胞表达主要的松弛素受体,并且,当松弛素结合时,它们从促纤维化表型转变为促溶解表型。后者释放外泌体,通过miR-30a-5p促进松弛素介导的激活肝星状细胞的静止。基于这些结果,研究者开发了脂质纳米颗粒,它优先靶向纤维化肝脏中激活的肝星状细胞,并封装松弛素基因和miR-30a-5p模拟物。基因组合疗法在小鼠肝纤维化模型中具有协同抗纤维化作用。
【15】J Extracell
Vesicles: 缺氧时促血管生成细胞外囊泡的分泌依赖于自噬相关蛋白GABARAPL1
doi:10.1002/jev2.12166
肿瘤缺氧是实体肿瘤的一个标志,有助于肿瘤进展、转移发展和治疗耐药性。在缺氧的反应,肿瘤细胞分泌促血管生成因子诱导血管形成和恢复氧供应的缺氧区域。细胞外囊泡(ev)是肿瘤微环境中细胞间通讯的媒介。
近日,马斯特里赫特大学研究人员发表在J Extracell Vesicles的一篇文章指出LC3/GABARAP蛋白家族成员GABARAPL1的表达增加是核内体成熟、核内体货物分类和ev分泌所必需的。研究者表明沉默GABARAPL1会导致早期核内体途径的阻断和具有促血管生成特性的ev的分泌受损。多西环素诱导的GABARAPL1敲除细胞的肿瘤异种移植显示血管化受损,导致肿瘤生长减少,肿瘤坏死增加和治疗疗效增加。
此外,研究者还发现 GABARAPL1在EV表面表达,用GABARAPL1靶向抗体靶向GABARAPL1 EV,可在体外阻断促血管生成作用。综上所述,我们揭示了GABARAPL1对于EV货物的装载和分泌是必需的。GABARAPL1 ev是可检测的和可靶向的,因此值得作为治疗靶点进行研究。(生物谷Bioon.com)
生物谷2021年终盘点正在进行!更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。