2021年终盘点:SARS-CoV-2重磅级研究成果!
来源:本站原创 2021-01-02 17:43
时至岁末,转眼间2021年已经接近尾声,迎接我们的将是崭新的2022年,在即将过去的2021年里,科学家们在SARS-CoV-2研究领域取得了多项重要的研究成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理,分享给大家!【1】Science:首次遇到的新冠病毒刺突蛋白影响对SARS-CoV-2变体的免疫反应doi:10.1126/s
时至岁末,转眼间2021年已经接近尾声,迎接我们的将是崭新的2022年,在即将过去的2021年里,科学家们在SARS-CoV-2研究领域取得了多项重要的研究成果,本文中,小编就对本年度科学家们在该研究领域取得的重磅级研究成果进行整理,分享给大家!
图片来源:Science, 2021, doi:10.1126/science.abm0811。
【1】Science:首次遇到的新冠病毒刺突蛋白影响对SARS-CoV-2变体的免疫反应
doi:10.1126/science.abm0811
在一项新的研究中,来自英国帝国理工学院和伦敦玛丽女王大学的研究人员发现人体通过疫苗接种或感染遇到的首个SARS-CoV-2刺突蛋白会影响他们随后对当前和未来的SARS-CoV-2变体的免疫反应。也就是说,它赋予的不同特性对保护免疫系统免受SARS-CoV-2变体感染的能力产生了影响,并且还影响了这种保护的衰减速度。相关研究结果于2021年12月2日在线发表在Science期刊上。
众所周知,在感染或接种疫苗后,抗体水平会随着时间的推移而减弱,但是这项新的研究表明,人体的保护性免疫反应也会受到他们所接触的哪种毒株或毒株组合的影响。在COVID-19大流行的23个月后,世界各地的人们根据他们的暴露情况对SARS-CoV-2病毒产生非常不同的免疫反应模式。在全球范围内,人们已经暴露于原始的SARS-CoV-2毒株和/或Alpha、Beta、Gamma、Delta变体以及现在的Omicron变体。此外,人们可能没有接种疫苗,或者已经接种了一至三针疫苗(使用原始毒株的刺突蛋白进行编程而构建出的)。
每种SARS-CoV-2变体的刺突蛋白都有不同的突变,而且这些作者发现,这些突变形成了随后的抗体和T细胞反应(免疫组库)。研究者Rosemary Boyton教授说,“我们通过感染或接种疫苗首次遇到刺突蛋白抗原,这通过免疫印记(immune imprinting)塑造了我们随后的免疫反应模式。暴露于不同的刺突蛋白可以导致对SARS-CoV-2变体的反应减少或增强。这对未来的疫苗设计和剂量选择策略具有重要意义。”
【2】Nat Commun:揭示SARS-CoV-2躲避宿主机体免疫系统攻击的新机制
doi:10.1038/s41467-021-26910-8
I类MHC所介导的抗原呈递通路在抗病毒免疫力发挥中扮演着关键的角色;近日,一篇发表在国际杂志Nature Communications上题为“SARS-CoV-2 inhibits induction of the MHC class I pathway by targeting the STAT1-IRF1-NLRC5 axis”的研究报告中,来自日本北海道大学等机构的科学家们通过研究发现,SARS-CoV-2或能敲除一种与I类MHC免疫复合体相关的重要分子通路,相关研究结果或能帮助科学家们更好地理解COVID-19感染发生的过程和分子机制。
研究者Koichi Kobayashi说道,我们的发现揭示了病毒如何逃逸人类机体的免疫防御系统,同时或能帮助解释为何该疾病的大流行会如此严重。研究者所发现的机制或能提供开发新型药物的新型分子靶点。文章中,研究人员利用生物信息学方法分析了诱发COVID-19的病原体SARS-CoV-2相比未感染个体而言是如何改变感染者机体免疫系统中的基因表达的,这是研究复杂细胞信号通路的一种有用的方法,这些信号通路会诱发机体抵御有害细菌和病毒的免疫反应。
I类MHC分子(主要组织相容性复合物)是机体免疫反应抵御病毒的核心武器,当病毒感染细胞时,细胞就会促进病毒抗原在受感染的细胞表面进行表达,并吸引细胞毒性T细胞的注意力,这些免疫细胞能锁定并随会被感染的细胞,以及入侵其内部的病毒。除了分析COVID-19患者体内的基因表达外,研究人员还利用SARS-CoV-2病毒感染人类细胞系来证实他们的研究发现。
【3】Science:揭示SARS-CoV-2变体正在进化出逃避抗体和疫苗的新方法
doi:10.1126/science.abl6251
在一项新的研究中,由美国哈佛医学院的研究人员领导的一个研究团队在预测SARS-CoV-2冠状病毒的未来进化策略的过程中鉴定出几种潜在的突变,这些突变将使这种病毒逃避免疫防御,包括通过感染或接种疫苗获得的自然免疫以及基于抗体的治疗。这些结果将有助于人们衡量SARS-CoV-2在继续适应其人类宿主的过程中可能如何进化,并以此帮助公共卫生官员和科学家为未来可能的突变做好准备。相关研究结果于2021年12月2日在线发表在Science期刊上。
事实上,在这项新的研究即将发表时,一种令人担忧的新变体---omicron---出现了,随后这些作者发现它包含了这篇新发表的论文中预测的几种可逃避抗体的突变。截至2021年12月1日,在非洲、亚洲、澳大利亚、欧洲和南北美洲的25个国家已经发现了omicron,这个名单每天都在增加。
这些作者提醒说,这些研究结果并不直接适用于omicron,因为这种特定的变体如何表现将取决于其自身的一组独特的突变---病毒刺突蛋白中至少有30种突变---之间的相互作用,以及它如何与世界各地人群中流通的其他活性毒株竞争。他们说,尽管如此,这项研究提供了有关omicron的值得关注的特定领域的重要线索,并且也为发现可能出现在未来变体中的其他突变奠定基础。
论文通讯作者、哈佛医学院Blavatnik研究所微生物学助理教授Jonathan Abraham说,“我们的发现表明,建议对omicron采取非常谨慎的态度,因为这些突变被证明相当有能力逃避用于治疗新感染患者的单克隆抗体和因mRNA疫苗接种而产生的抗体。”这些作者没有研究这种病毒对接种非mRNA疫苗而产生的抗体的抵抗能力。
图片来源:Cell, 2021, doi:10.1016/j.cell.2021.11.026。
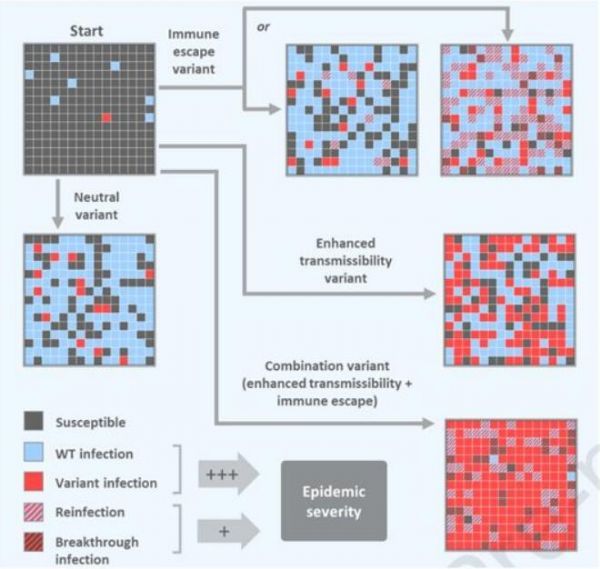
【4】Cell:类似于Delta变体的SARS-CoV-2变体最可能增加COVID-19大流行的严重性
doi:10.1016/j.cell.2021.11.026
在一项新的研究中,来自美国哈佛大学陈曾熙公共卫生学院的研究人员构建出一种数学模型,发现具有与Delta变体相似特征的SARS-CoV-2变体---增强了传播性和感染以前感染/接种过疫苗的人的能力---将引起更严重的大流行病,与单独具有这两种特征之一的SARS-CoV-2变体相比,导致更多的感染和突破性感染/再感染。这些发现有可能帮助科学家们和公共卫生官员解释新变体和现有变体的重要性,并根据变体的特征为各种情况设计有针对性的公共卫生对策。相关研究结果于2021年11月18日在线发表在Cell期刊上。
研究者Mary Bushman说,“迄今为止,免疫逃逸(immune escape)---一种变体逃避免疫系统并导致再感染或突破性感染的能力---的证据好比是红旗(red flag,危险的信号)。我们的研究结果表明,这也许更像是黄旗(yellow flag)---这本身并不是一个大问题。但是当它与增强的传播性相结合时,那么它就可能是一个真正的大问题。”
随着COVID-19大流行的进展,最初的野生型SARS-CoV-2病毒的变体已经出现。一些变体迅速成为主导毒株并增加了感染人数,如Alpha变体和Delta变体,而其他变体,如Beta变体,未能占据主导地位或对COVID-19大流行的发展轨迹产生重大影响。为了了解某些因素对COVID-19大流行的影响,Bushman构建出一种数学模型,它模拟由假设的变体推动的大流行将如何影响正在使用戴口罩与物理距离和疫苗接种各种组合的人群。
【5】Science:大规模研究构建出数百种人类抗体结合SARS-CoV-2图谱,有望开发出更有效的COVID-19抗体疗法
doi:10.1126/science.abh2315
在一项新的研究中,来自美国拉霍亚免疫学研究所的研究人员发布了人类抗体与SARS-CoV-2结合的详细图谱,该图谱是通过全球合作比较几乎所有领先的临床候选抗体药物产生的。这项新研究将指导开发更有效的COVID-19抗体疗法,并帮助科学家们开发有效的疫苗以应对新出现的病毒变体。相关研究结果于2021年9月23日在线发表在Science期刊上。
这些研究发现在三个关键方面推动了COVID-19研究:(1)对全世界50多个不同组织提供的数百种抗体进行了分类和结合图谱绘制;这项研究显示了每种抗体在SARS-CoV-2的刺突蛋白(S蛋白)上结合的确切位置;(2)这些研究人员描述了每种抗体的中和强度,或效力,以及每种抗体对病毒变体提供保护的可能性;(3)在S蛋白上有类似足迹的抗体被归类为相同的“群体(communities)”;这些研究人员展示了来自不同群体的抗体如何被组合成强大的抗体“鸡尾酒”来靶向SARS-CoV-2。
论文通讯作者、拉霍亚免疫学研究所教授Erica Ollmann Saphire博士说,“我们能够绘制S蛋白的地理图,并了解哪些抗体与它的哪些足迹结合。该图谱提供了一个参考,以帮助预测哪些抗体对SARS-CoV-2变体仍然有效,如目前病例激增的Delta变体。”Saphire领导了这项研究背后的称为冠状病毒免疫治疗联盟(Coronavirus Immunotherapeutic Consortium, CoVIC)的全球努力。
【6】Science:揭示SARS-CoV-2校对外切核酸酶识别错配核苷酸机制
doi:10.1126/science.abi9310
引起COVID-19的冠状病毒SARS-CoV-2已经表现出顽强抵抗大多数核苷类抗病毒药物治疗的能力。如今,在一项新的研究中,来自美国爱荷华州立大学、明尼苏达大学奥斯汀分校和耶鲁大学医学院的研究人员详细介绍了SARS-CoV-2中存在的一种关键酶的结构。这种称为校对外切核酸酶(proofreading exoribonuclease, ExoN)的酶从这种病毒的RNA中去除核苷类抗病毒药物,使大多数基于核苷类似物的抗病毒药物治疗无效。他们解析出ExoN酶的原子结构,这可能导致人们开发新的方法来使这种酶失活,并为COVID-19患者打开更好的治疗方法。相关研究结果于2021年7月27日在线发表在Science期刊上。
论文共同通讯作者、爱荷华州立大学生物物理学与分子生物学系助理教授Yang Yang说,“如果我们能找到一种抑制这种酶的方法,也许我们用现有的核苷类抗病毒药物杀死这种病毒会取得更好的效果。了解这种结构和ExoN如何发挥作用的分子细节可以帮助指导抗病毒药物的进一步开发。”
SARS-CoV-2是一种RNA病毒,这意味着它的遗传物质是由RNA组成的。当该病毒复制时,它必须合成RNA。但是与其他RNA病毒相比,该病毒的基因组异常庞大,这就造成了在RNA合成过程中出现错误的可能性相对较大。这些错误以不匹配的核苷酸的形式出现,而过多的错误会阻止这种病毒的传播。
ExoN位于非结构蛋白(nsp)10-nsp14复合物中,通过校对RNA合成提高病毒复制的保真度,对病毒的生命周期至关重要。ExoN还能识别和切除整入新生病毒RNA的核苷酸类似物抑制剂,破坏了基于核苷酸类似物的抗病毒药物的有效性。Yang说,但是ExoN酶充当了校对者的角色,识别病毒RNA中的错配,并校正RNA合成过程中出现的错误。他说,这种酶只存在于冠状病毒和其他一些亲缘关系密切的病毒家族中。
青蒿素及相关衍生物青蒿琥酯和蒿甲醚。
图片来源:Scientific Reports, 2021, doi:10.1038/s41598-021-93361-y。
【7】Nature子刊:发现青蒿素及其衍生物可抑制SARS-CoV-2病毒感染
doi:10.1038/s41598-021-93361-y
在一项新的研究中,来自德国柏林自由大学、马克斯-普朗克胶体与界面研究所、丹麦哥本哈根大学和中国香港城市大学的研究人员发现,在实验室条件下,来自黄花蒿(artemisia annua)植物的几种提取物可抑制SARS-CoV-2病毒。相关研究结果于2021年7月16日发表在Scientific Reports期刊上。
在这篇论文中,这些作者描述了他们测试的三种黄花蒿植物提取物,以及它们在人类肺部组织中对抗SARS-CoV-2病毒的情况。虽然最近几个月COVID-19大流行病的主要焦点变成了可有效预防COVID-19的疫苗,但对那些未接种疫苗而感染了SARS-CoV-2病毒的人的治疗工作仍在继续。
黄花蒿是一种艾属植物,产于亚洲和北美的部分地区。它通常有各种各样的名字,如苦艾。它的提取物被用作疟疾治疗,最常见的治疗类型是基于青蒿素(artemisinin)的。青蒿素的衍生物包括青蒿琥酯(artesunate)和蒿甲醚(artemether),这两种药物都被用来治疗疟疾患者,具有可靠的安全记录。在这项新研究中,这些作者试图确定青蒿素或其衍生物是否可能有效治疗COVID-19患者。为了找到答案,他们在培养皿中用SARS-CoV-2病毒感染人体组织,然后加入青蒿素或其衍生物。
【8】Nat Immunol:发现一种新的抵御SARS-CoV-2机制
doi:10.1038/s41590-021-00942-0
导致COVID-19的冠状病毒SARS-CoV-2正在全球肆虐。在首次报告COVID-19和这种大流行病蔓延以来的18个月里,已经进行了大量的研究来了解它和开发治疗它的方法。根据美国霍普金斯大学的最新统计数据(https://coronavirus.jhu.edu/map.html),超过1.69亿人遭受SARS-CoV-2感染。SARS-CoV-2对所有感染者的影响不尽相同。在这些感染者中,大约35%~40%的患者出现了轻微的症状,而其余19%的患者出现了足以住院或致命的症状,这些症状通常与慢性阻塞性肺病(COPD)等合并症和风险因素有关。这种不同的症状表现表明,个人对这种病毒的反应存在巨大的差异。这方面的原因并不完全清楚,是正在研究的一个重要领域。
在一项新的研究中,来自日本北海道大学的研究人员发现了一种针对SARS-CoV-2的新型防御反应,它涉及病毒模式识别受体RIG-I。上调这种蛋白质的表达可以加强COPD患者的免疫反应。他们发现作为一种检测RNA病毒的分子,RIG-I抑制了SARS-CoV-2在人类肺部细胞中的复制。这可能有助于预测COVID-19患者的结果。相关研究结果近期发表在Nature Immunology期刊上。
我们体内的微生物病原体是由称为模式识别受体(PRR)的蛋白质检测出来的,这些蛋白质也会触发对这些病原体的免疫反应。病毒感染是由PRR的一个亚群检测出来的;科学家们将注意力集中在属于这个亚群的RIG-I蛋白质上。众所周知,RIG-I对于检测和应对RNA病毒(如流感病毒)至关重要。在针对体外培养的细胞系进行的实验中,这些作者发现在肺细胞中对SARS-CoV-2几乎没有先天免疫反应,这表明导致免疫反应的信号通路被中止了。然而,这种病毒的复制受到抑制。他们调查了RIG-I的作用,发现它的缺乏导致病毒复制增加。进一步的实验证实,对病毒复制的抑制是依赖于RIG-I的。
【9】Nat Med:科学家发现SARS-CoV-2病毒或能感染人类口腔中的细胞!
doi:10.1038/s41591-021-01296-8
日前,一篇刊登在国际杂志Nature Medicine上题为“SARS-CoV-2 infection of the oral cavity and saliva”的研究报告中,来自美国国立卫生研究院等机构的科学家们通过研究发现,引发COVID-19的病毒SARS-CoV-2或能感染口腔中的细胞。众所周知,上呼吸道和肺部组织是SARS-CoV-2感染的主要部位,但有研究线索表明,该病毒还会感染机体其它部位,比如消化道、血管、肾脏等,而本文最新研究表明,SARS-CoV-2还能感染口腔;其感染机体其它多个部位的潜力或能帮助解释COVID-19患者机体所出现的广泛的疾病症状,包括味觉丧失、口干及口腔起泡等口腔症状。此外,本文研究结果还指出,口腔或许在SARS-CoV-2传播到肺部和消化系统中扮演着关键角色,而这一过程是通过富含感染口腔细胞的病毒的唾液来实现的,更好地理解口腔在其中扮演的角色或能帮助开发减少病毒在体内和体外扩散传播的新型策略。
研究者Rena D'Souza表示,由于NIH为应对疫情采取了全员参与的应对措施,来自美国国立牙科和颅面研究所的研究人员也借助他们在口腔生物学和医学方面的专业知识来帮助回答有关COVID-19的关键问题。研究人员阐明了口腔在SARS-CoV-2感染和传播过程中扮演的关键角色,这一研究发现增加了目前科学家们对有效防治COVID-19的观点和知识。
如今研究人员已经知道,COVID-19患者的唾液中含有高水平的SARS-CoV-2,而且研究表明,唾液检测用于诊断COVID-19与鼻腔深部拭子的检测一样可靠。然而,科学家们并不是非常清楚的是,唾液中的SARS-CoV-2来自于哪里?在表现呼吸道症状的COVID-19患者群体中,唾液中的病毒很有可能来自于其鼻腔引流液或从肺部咳出的痰液,但研究者表示,这或许无法解释病毒是如何进入并未表现出呼吸道症状患者的口腔唾液中的。基于实验室的研究数据,研究人员推测,至少唾液中的一部分你病毒可能来自于患者口腔本身被感染的组织。
为了探索这种可能性,研究人员调查了来自健康人群的口腔组织来确定对SARS-CoV-2感染易感的口腔区域;易感细胞中含有特殊的RNA序列,其能帮助制造“进入蛋白”来帮助病毒进入细胞,研究人员在唾液腺和口腔内组织的某些细胞中发现了两种编码特殊进入蛋白的RNA,这两种蛋白质分别为ACE2受体和TMPRSS2酶,在一小部分唾液腺和牙龈细胞中,编码产生ACE2和TMPRSS2的RNA在同一细胞中表达,这就表明,易感性的增加是因为病毒被认为需要两种进入蛋白才能进入细胞。
图片来源:Cell, 2021, doi:10.1016/j.cell.2021.03.028。
【10】Cell:N末端结构域抗原图谱揭示SARS-CoV-2的脆弱位点
doi:10.1016/j.cell.2021.03.028
科学家们了解到,抗击COVID-19感染的抗体识别出了大流行性冠状病毒SARS-CoV-2的一个较少研究的区域。这些抗体在以前感染患者的血液样本中被发现,并被发现能有效地防止病毒感染细胞。SARS-CoV-2刺突蛋白是打开细胞大门的钥匙,抗体与刺突蛋白结合来阻断这一功能。人们对研究靶向刺突蛋白的受体结合结构域(RBD)的抗体给予了很多关注。(刺突蛋白RBD负责触发这种病毒与宿主细胞的融合,从而实现对后者的接管)。
然而,来自康复患者的一些抗体通过与病毒刺突蛋白上的另一个地方---N末端结构域(N-terminal domain, NTD)---结合来阻断这种病毒。最近的一项研究显示,这些抗体与那些结合RBD的抗体一样强效。在一项新的研究中,来自美国华盛顿大学等研究机构的研究人员利用电子冷冻显微镜(cryo-EM)绘制这些抗体的结合位置图,发现所有防止感染的抗体都与NTD的一个地方结合。它表明,这些抗体保护了叙利亚仓鼠免受SARS-CoV-2感染。相关研究结果于2021年3月16日在线发表在Cell期刊上。
最近的其他研究结果表明,这种病毒正在慢慢地抵抗人们获得的这些抗体。这种病毒正在通过积累突变来适应这些抗体,这些突变帮助它逃脱免疫防御,成为所谓的令人担忧的病毒变体。这些变体中的一些,比如在英国和南非首次发现的变体,包含的突变似乎让这种病毒不易受到抗NTD抗体的中和力的影响。
这些研究人员指出,“几种SARS-CoV-2变体在它们的NTD超级位点(supersite)内携带突变。这表明存在持续的选择压力。”他们补充说,研究这些中和逃逸机制可揭示这种病毒的NTD获得抗体抵抗性的一些非常规方式,也是为什么NTD变体需要接受更密切的监测。
这项研究中的抗NTD抗体来源于记忆B细胞,其中记忆B细胞是一种白细胞,可以持久地识别以前遇到的病原体,并重新启动免疫反应。(生物谷Bioon.com)
生物谷2021年终盘点正在进行!更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。