美国FDA批准Tyvaso(曲前列尼尔):治疗间质性肺病相关肺动脉高压(PH-ILD)的药物!
来源:本站原创 2021-04-05 17:18
Tyvaso是美国第一个也是唯一一个被批准治疗PH-ILD的疗法。

2021年04月05日讯 /生物谷BIOON/ --联合治疗公司(United Therapeutics)近日宣布,美国食品和药物管理局(FDA)已批准Tyvaso(treprostinil,曲前列尼尔)吸入性溶液,用于治疗间质性肺病相关肺动脉高压(PH-ILD;WHO第3组)患者,改善运动能力。这是FDA批准Tyvaso的第二个适应症。此前,FDA于2009年7月首次批准Tyvaso,用于治疗肺动脉高压(PAH,WHO第1组)患者,改善运动能力。
值得一提的是,Tyvaso是美国第一个也是唯一一个被批准治疗PH-ILD的疗法。Tyvaso的批准上市,标志着PH-ILD领域的一个里程碑式的治疗进步。PH-ILD是一种严重的威胁生命的疾病,在美国有约3万例患者,该领域存在着显著未满足的医疗需求。在关键INCREASE研究中,Tyvaso治疗显著改善了患者的运动能力。
INCREASE研究指导委员会主席、布里格姆妇女医院肺血管疾病项目主任Aaron Waxman博士表示:“同时患有间质性肺病和肺动脉高压的成人患者,由于呼吸急促、运动耐力差和死亡率增加,生活质量通常很差。到目前为止,治疗这些患者的临床医生还没有任何经批准的治疗方案。对于PH-ILD患者和治疗这种严重威胁生命疾病的医生来说,Tyvaso(一种吸入疗法)的监管批准都是令人兴奋的消息。这将改变我们管理这些患者的方式。”
United Therapeutics公司主席兼首席执行官Martine Rothblatt博士表示:“FDA批准Tyvaso治疗PH-ILD患者,对这一弱势患者群体来说是一个里程碑式的治疗进步。它还强调了我们致力于推动肺动脉高压领域的创新,并扩大能够从Tyvaso获得临床益处的患者数量。我们计划利用我们的经验和扩大的基础设施,将这种安全有效的吸入疗法带给美国许多患有PH-ILD的患者。”

PH-ILD(图片来源:thecardiologyadvisor.com)
间质性肺病(ILD)是一组以肺内细支气管和肺泡囊明显瘢痕或纤维化为特征的肺部疾病。ILD中纤维化组织增多会阻碍肺毛细血管和肺泡囊之间的氧合和自由气体交换,这种情况下患者会出现多种症状,包括活动性呼吸短促、呼吸困难和疲劳。
世卫组织第3组肺动脉高压(PH)经常使间质性肺病患者的病程复杂化,并与较差的运动能力、更大的补氧需求、生活质量下降和更差的预后相关。据估计,PH至少影响15%的早期ILD患者(美国约有30000名PH-ILD患者),并可能影响86%的更严重ILD患者。
FDA批准Tyvaso治疗PH-ILD的补充新药申请(sNDA),基于来自INCREASE研究的数据支持。该研究是在PH-ILD成人患者中开展的最大、最全面的研究。这是一项多中心、随机、双盲、安慰剂对照、为期16周的平行组研究,共入组了326例患者。
结果显示,该研究达到了主要终点:接受Tyvaso治疗的患者,6分钟步行距离(6MWD)有显著改善。该研究结果已发表在国际医学期刊《新英格兰医学杂志》(NEJM)上,并在最近的联合治疗公司的投资者会议上讨论。研究结果也显示了Tyvaso在所有关键亚组中的治疗益处,包括PH-ILD的病因、疾病严重程度、年龄、性别、基线血流动力学和剂量。在每个次要终点上也观察到了显著的改善,包括心脏生物标志物proBNP的减少、首次临床恶化事件发生的时间、第12周时6MWD峰值的变化、第15周时6MWD谷值的变化。其他观察包括安慰剂校正的用力肺活量(FVC)的改善,以及接受Tyvaso治疗的患者内在肺部疾病的显著减少。在该研究中,每天4次,每次最多呼吸12次的Tyvaso治疗具有良好的耐受性,其安全性与以前的Tyvaso研究和已知的前列环素相关不良事件一致。
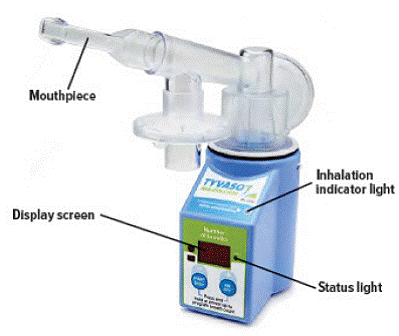
Tyvaso的活性药物成分为曲前列尼尔(treprostinil),这是一种人工合成的前列环素模拟物,主要通过直接舒张肺和全身动脉血管床并抑制血小板聚集发挥作用。
United Therapeutics公司已针对曲前列尼尔开发出了多种剂型,包括:Tyvaso(吸入性溶液)、Orenitram(缓释片)、Remodulin(注射剂)。目前,United Therapeutics公司也正在开发一款干粉剂Tyvaso DPI,这是Tyvaso的下一代干粉配方,有望提供比传统雾化Tyvaso疗法更方便的给药方法。
今年1月,评估Tyvaso DPI治疗肺动脉高压(PAH)的BREEZE研究达到了主要终点:证明了PAH患者从Tyvaso(曲前列尼尔)吸入性溶液过渡到Tyvaso DPI的安全性和耐受性。此外,在健康志愿者中进行的药代动力学(PK)研究表明,Tyvaso DPI和Tyvaso吸入溶液之间的曲前列尼尔暴露具有可比性。
United Therapeutics公司计划于2021年4月向FDA提交Tyvaso DPI的新药申请(NDA),涵盖肺动脉高压(PAH)和间质性肺病相关(PH-ILD)适应症。该公司计划针对Tyvaso DPI NDA提交一张优先审查凭证(PRV),以加快FDA的审查周期。如果获得批准,Tyvaso DPI预计将在吸入曲前列尼尔治疗方面取得重大进展,与现有的Tyvaso吸入性溶液相比,可提供给药方便的优势。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


