精氨酸甲基化酶(PRMTs)和精氨酸甲基化—癌症最保守的秘密?
来源:诺禾质谱 2019-07-19 11:36
蛋白的翻译后修饰是引起蛋白质组多样性和细胞动态平衡的关键因素,蛋白的翻译后修饰失调将会导致癌症发生。越来越多的研究证明精氨酸甲基化与癌症的发展相关,精氨酸甲基化酶(PRMTs)也成了药物靶标的热门研究对象。本文从 PRMTs 在干细胞生物学、表观遗传学、可变剪切、免疫监控以及 DNA 损伤应答等方面的作用进行了阐述,并关注了目前临床试验治疗癌症的特异性靶标。1癌症生物学中精氨酸甲基化异
蛋白的翻译后修饰是引起蛋白质组多样性和细胞动态平衡的关键因素,蛋白的翻译后修饰失调将会导致癌症发生。越来越多的研究证明精氨酸甲基化与癌症的发展相关,精氨酸甲基化酶(PRMTs)也成了药物靶标的热门研究对象。本文从 PRMTs 在干细胞生物学、表观遗传学、可变剪切、免疫监控以及 DNA 损伤应答等方面的作用进行了阐述,并关注了目前临床试验治疗癌症的特异性靶标。
1
癌症生物学中精氨酸甲基化异常
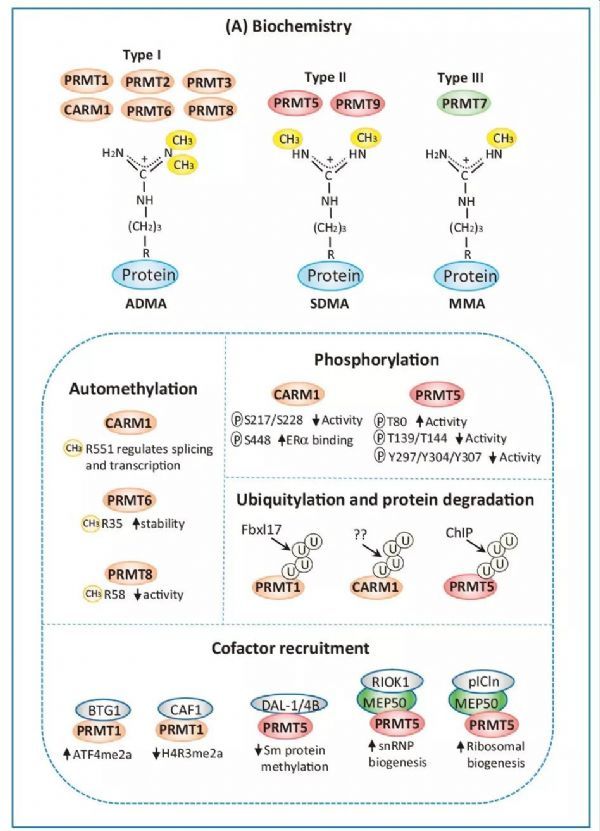
精氨酸甲基化由 PRMTs 调控,已知的 PRMTs 有9种(PRMT1、PRMT2、PRMT3、PRMT6、PRMT8、CARM1、PRMT5、PRMT9、PRMT7),分别催化形成单甲基化(MMA),对称二甲基化(SDMA)和非对称二甲基化(ADMA)(图1A)。
近些年的研究证明了 PRMTs 调控了表观遗传介导的基因表达、mRNA 剪接、DNA 损伤应答、干细胞功能以及免疫反应等与肿瘤发生发展密切相关的生物学过程(图1B)。
图1B 精氨酸甲基化的生化、细胞生物学及临床相关性
研究发现癌症患者 PRMTs 的表达量升高且伴随着不良的预后,因此,PRMTs 成为了癌症药靶研究的新热点,仅三年的时间,PRMT1 和 PRMT5 抑制剂就进入了一期临床试验,为实体瘤和血液肿瘤的治疗开辟了新的道路(图2)。
2
PRMTs和表观遗传
PRMTs 通过对表观遗传的调控影响细胞活性。PRMT1 和 CARM1 分别催化组蛋白 H4 和 H3 的精氨酸发生非对称二甲基化 H4R3me2a 和 H3R17me2a,导致 DNA 拓扑异构酶Ⅲβ(TOP3B)在新的转录位点聚集,引起转录的发生。研究表明 PRMT1 的过表达引起 H4R3me2a 介导的上皮间充质转化(EMT),而 H4R3me2a 的去甲基化也是白血病发病的必要因素。因此,PRMT1 的靶向药物可能通过抑制癌细胞异常表观遗传而发生疗效。
PRMT5 也可以表观调控基因的表达,根据被修饰残基的不同而促进或抑制转录。例如 PRMT5 催化第三位精氨酸发生对称二甲基化 H4R3me2s,可以抑制基因转录,而第二位精氨酸发生对称二甲基化 H4R2me2s 后却促进基因的转录。
3
PRMTs和mRNA剪切
此外,PRMT1 在急性巨核细胞白血病(AMKL)中过表达,且患者死亡率高。PRMT9 最近被报导在肝细胞癌中上调并且促进癌细胞的侵袭和转移。二者均与可变剪切有关。
4
PRMTs和DNA修复及耐药性
DNA 损伤修复失败会导致基因组不稳定而引发癌症,细胞自身具有 DNA 损伤后修复的功能,磷酸化和泛素化已被证明在 DNA 损伤后修复中发挥作用。精氨酸甲基化也不例外,PRMT1 和 PRMT5 缺失的小鼠胚胎成纤维细胞表现出自发的 DNA 损伤、检查点缺陷和基因组不稳定性。研究表明 PRMT5 在 DNA 损伤后会被动态调控发挥修复功能。
癌细胞耐受化疗药物的主要机制是通过上调关键的 DNA 修复基因实现的,那么联合使用 PRMT5 抑制剂和 DNA 损伤剂可能是治疗耐药癌症的有效策略。实验证明 PRMT5 抑制剂联合 olaparib 治疗耐药的人 AML 细胞,显着降低了 AML 细胞的存活率。该方案在三阴乳腺癌的治疗中都也表现出疗效。
5
癌症干细胞(CSC)相对于大量的肿瘤细胞而言,具有更强的耐药性。目前的治疗通常有效地去除肿瘤组织而不能消除引发肿瘤的细胞,因此,CSCs 是药物抗性、转移和复发的主要因素。有趣的是,精氨酸甲基化在维持干细胞特性方面的作用越来越明显:PRMT1是维持干细胞多能性所必需的,而CARM1表观遗传上调了关键的多能基因 Oct 4、Sox 2 和 Nanog,PRMT5 上调了胚胎干细胞(ES)中的 Nanog 和 Oct 4 基因并促进体细胞重编程,此外 PRMT7 和 PRMT8 也具有类似的功能。
最近的研究表明 PRMT5 在慢性髓细胞样白血病(CML)干细胞和乳腺癌干细胞中高表达,以维持干细胞自身的增殖。在异种移植的乳腺癌模型中,PRMT5 缺失导致乳腺癌干细胞数量的显着减少。
6
PRMTs和免疫治疗
调节T细胞(Treg)可以抑制免疫系统攻击自身抗原,浸润了 Treg 的肿瘤因 Treg 的免疫抑制作用,使预后变差。研究表明,条件敲除 PRMT5 基因,可以降低 Treg 的免疫抑制作用,因此,开发靶向 PRMT5 的药物,可能是一种有效的抑制肿瘤的途径。
7
PRMT抑制剂的未来
从遗传学研究中可以看出,PRMT 在成年小鼠的发育和正常稳态中发挥着关键作用(表1),PRMT 抑制剂的药物开发会是一个好的选择吗?事实上,PRMT 在基因层面上敲除和 PRMT 蛋白抑制剂使用,对表型的影响是不同的。例如,条件性敲除 Prmt5 基因导致小鼠造血母细胞丢失,引起致死性再生障碍性贫血和骨髓衰竭,而用 PRMT 抑制剂处理正常人脐血 CD34+ 造血干细胞时却并没有出现这些现象。
表1 敲除或条件敲除 PRMT 酶后的表型
结语: 尽管确认 PRMTs 在癌症生物学中的意义花费了近50年的时间,但跟 PRMT 有关的重大发现却是发展迅速的,精氨酸甲基化走出了赖氨酸甲基化的“阴影”进入了研究者的视线,尤其是 PRMT5 在癌症中的作用越来越被证实,相信在未来,其他8种 PRMTs 的作用也将被逐一揭开。在下一代的抗癌治疗中,PRMT 将会发挥重要的作用。(生物谷Bioon.com)
小编推荐会议 2019临床质谱与高端医学检验发展论坛
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。