CAR-T细胞疗法研究进展(第12期)
来源:本站原创 2020-02-29 23:59
2020年2月29日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样
2020年2月29日讯/生物谷BIOON/---CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受体T细胞免疫疗法。该疗法是一种出现了很多年但近几年才被改良使用到临床中的新型细胞疗法。在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是最有前景的肿瘤治疗方式之一。正如所有的技术一样,CAR-T技术也经历一个漫长的演化过程,正是在这一系列的演化过程中,CAR-T技术逐渐走向成熟。
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Nat Biotechnol:为CAR-T细胞疗法设计一个紧急停止开关
doi:10.1038/s41587-019-0403-9
作为一种免疫疗法,嵌合抗原受体(CAR)T细胞(CAR-T)涉及提取患者体内的T细胞,对它们进行基因改造使得它们能够识别和杀死癌细胞。然而,当这些经过基因改造的T细胞靶向实体瘤时,它们也可以攻击健康组织,从而导致毒副作用、主要器官损伤甚至可能导致死亡。在一项新的研究中,来自瑞士洛桑联邦高等理工学院和洛桑大学等研究机构的研究人员开发出一种新的基于计算设计蛋白(computationally designed proein,即通过计算方法设计出的蛋白)的方法,可根据指令关闭这些经过基因改造的CAR-T细胞---一种为治疗反应不佳的患者设计的紧急停止开关。这种称为STOP-CAR的控制开关已在注入前列腺癌细胞的小鼠身上进行了测试和验证。这一发现可能加快以前被认为风险太大的新型CAR-T细胞疗法的临床开发。相关研究结果于2020年2月3日在线发表在Nature Biotechnology期刊上,论文标题为“A computationally designed chimeric antigen receptor provides a small-molecule safety switch for T-cell therapy”。
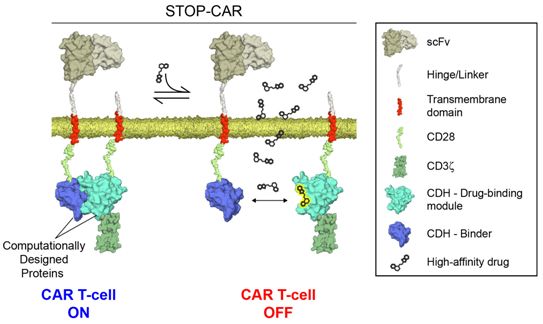
这种控制开关涉及将一种小分子作为单独的药物给予患者。CAR-T细胞包含一对天然结合的蛋白,这对蛋白在CAR受体和T细胞内部结构之间传递信息。这种小分子破坏了这些蛋白之间的相互作用,从而破坏了这种信号并有效地关闭了这些T细胞。
论文共同通讯作者、洛桑联邦高等理工学院生物工程研究所助理教授Bruno Correia解释道,“这种控制开关的真正优势在于如果我们停止给予这种小分子,我们就能够再次开启CAR-T细胞。如果CAR-T细胞对患者的健康构成威胁,那么它们也无需被破坏。这种控制开关使得我们能够精确控制免疫疗法的作用。”
2.Nano Lett:利用可电离的脂质纳米颗粒递送mRNA可降低CAR-T细胞疗法的毒副作用
doi:10.1021/acs.nanolett.9b04246
如今,在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现一种对T细胞毒性更小的新工程技术可以通过一种不同的机制来改变它们识别癌症的方式。利用使用这种机制的T细胞进行治疗可能给患者带来更少的副作用。相关研究结果于2020年1月17日在线发表在期刊上,论文标题为“Ionizable Lipid Nanoparticle Mediated mRNA Delivery for Human CAR T Cell Engineering”。论文通讯作者为宾夕法尼亚大学工程与应用科学学院生物工程系希尔卡尼克创新助理教授Michael Mitchell博士。论文第一作者为Mitchell实验室研究生Margaret Billingsley。
这种新工程技术涉及利用基于脂质的纳米颗粒跨过T细胞的细胞膜来递送信使RNA(mRNA),而不是使用经过基因修饰的病毒来重写T细胞的DNA。使用前一种方法将是更可取的,这是因为它只会暂时改变患者的免疫系统,但是目前让mRNA穿过细胞膜的标准方法(即电穿孔)可能会产生太大毒性,以致无法从患者体内获得所需数量的T细胞。
在体外实验中,这些研究人员发现通过他们的纳米颗粒表达CAR的T细胞在杀死癌细胞方面与目前临床使用的经过病毒基因改造的CAR-T细胞一样有效。 接下来的研究计划包括对这种递送平台的影响进行体内研究,以确定CAR瞬时表达对治疗功效和副作用的影响。
3.Cancer Discov:导致癌细胞出现CAR-T耐受性的原因
doi:10.1158/2159-8290.CD-19-0813
在最近一项研究中,宾夕法尼亚大学艾布拉姆森癌症中心的研究人员描述了癌细胞的死亡受体信号途径如何影响其对CAR T细胞的耐受性。这些发现可能为CAR T疗法受性的血液癌患者提供治疗方面指导。相关结果发表在最近的《Cancer Discovery》杂志上。
研究人员首先对称为Nalm6的ALL细胞系进行了基于全基因组CRISPR / Cas9的筛选,以分离与CAR T耐受性产生相关的信号途径。研究小组发现,在所有抗CAR T治疗的细胞中,都有细胞死亡信号途径的基因(FADD,BID,CASP8和TNFRSF10B)的活性下降的现象,而抗细胞死亡途径所需的基因(CFLAR,TRAF2和BIRC2)则表达水平较高。当他们在动物模型中对此进行测试时,其效果甚至超过了他们在体外观察到的效果。进一步,作者发现癌细胞的这些变异导致癌细胞的生存期延长以及T细胞功能障碍。
之后,该团队分析了来自患者群体中应答者和非应答者的白血病细胞和T细胞(输注前后)中的基因表达情况。他们发现,在两项临床试验中,癌细胞中的死亡受体信号传导途径与对CAR治疗的反应性直接相关,进一步表明死亡受体信号传导是ALL患者对CAR T治疗产生耐受性的关键调节因子。
4.Cancer Cell:给CAR-T细胞装上一个安全开关,可微调它们的活性
doi:10.1016/j.ccell.2019.12.014
在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员报道了关于共刺激分子调控的新发现。这些发现有可能允许人们对杀死癌症的免疫细胞---经过基因改造后表达嵌合抗原受体(CAR)的T细胞(CAR-T)---进行微调,从而提高它们杀死肿瘤的能力,或者在严重副作用的情形下降低它们的活性。相关研究结果于2020年1月30日在线发表在Cancer Cell期刊上,论文标题为“THEMIS-SHP1 Recruitment by 4-1BB Tunes LCK-Mediated Priming of Chimeric Antigen Receptor-Redirected T Cells”。论文通讯作者为北卡罗来纳大学教堂山分校莱恩伯格综合癌症中心的Gianpietro Dotti博士。
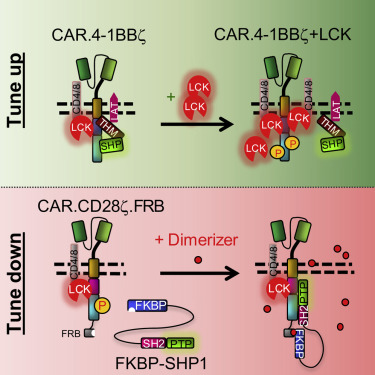
他们开发出对两种不同类型的经过基因修饰的T细胞进行改进的策略。这两种类型的CAR-T细胞可通过激活它们的信号来加以区分。首先,它们具有识别肿瘤上特定标志物的受体---第一个信号。它们还需要第二个信号来协助完全激活它们并增加它们的反应。这两种不同类型的T细胞需要不同的“第二信号”来激活它们。
一种类型的CAR-T细胞由CD28蛋白共同刺激,另一种类型的CAR-T细胞由4-1BB刺激。 这些研究人员希望找到一种调节这些蛋白的方法,以“微调”这些细胞的抗疾病反应,这是因为这两种类型的CAR-T细胞在体内通常持续存在多长时间来抵抗癌症、它们如何快速地作出反应以及这种反应的强度上存在差异。对于由4-1BB共同刺激的CAR-T细胞,他们发现他们可以增加LCK分子的表达,从而增加这些细胞的活性。
这些研究人员还报道了一种新的“安全开关”机制以降低由CD28共同刺激的CAR-T细胞的活性。如果患者在实验性CAR-T细胞免疫疗法中经历严重的副作用,那么医生就可能使用这种安全开关。他们发现他们可以使用一种称为SHP1的分子来降低T细胞活性。当他们添加某种药物时,SHP1会与CAR结合,从而降低CAR-T细胞的活性。
5.Nature:揭示儿茶酚胺在免疫治疗过程中引发细胞因子风暴机制
doi:10.1038/s41586-018-0774-y
许多新近开发的强效癌症疗法旨在利用靶向肿瘤的免疫反应。但是,这类免疫疗法的一个普遍问题是发生了严重的炎症反应,即细胞因子风暴(cytokine storm)。在细胞因子风暴中,称为细胞因子的蛋白的水平异常高。这会导致发烧,低血压,心脏问题,并在某些情况下导致器官衰竭和死亡。因此,人们非常有兴趣了解细胞因子风暴形成的内在机制,以便开发阻止它的方法,同时不会改变抗癌治疗的疗效。
在一项新的研究中,来自美国约翰霍普金斯大学基梅尔癌症中心和约翰霍普金斯大学医学院的研究人员揭示出蛋白ANP(atrial natriuretic peptide, 心房利钠肽)能够阻断细胞因子风暴,而且他们在免疫细胞中发现了一种自我扩增的产生环路(self-amplifying production loop),该环路产生一类称为儿茶酚胺的分子,包括肾上腺素。他们报道这种儿茶酚胺产生有助于启动和维持细胞因子风暴。相关研究结果近期发表在Nature期刊上,论文标题为“Disruption of a self-amplifying catecholamine loop reduces cytokine release syndrome”。
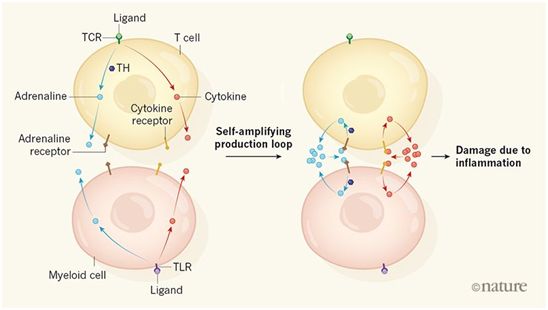
这些研究人员提供了令人信服的证据证实免疫细胞释放儿茶酚胺的自我扩增环路启动了细胞因子风暴。但是,确定这种环路的详细信息将需要开展进一步的研究。比如,免疫细胞的激活如何促进儿茶酚胺水平的增加,以及儿茶酚胺如何促进细胞因子的产生,这些都是未知的,应当进行研究。另一个谜团是哪种类型的肾上腺素能受体对于儿茶酚胺对人体细胞因子水平的影响至关重要。ANP具有抗炎特性,但是它如何抑制儿茶酚胺产生是另一个未解决的关键问题,这值得进一步开展研究。
这些发现可能会导致在免疫疗法中开发出应对细胞因子风暴的新策略。 CAR-T细胞免疫疗法的小鼠模型表明髓样细胞的激活在驱动细胞因子风暴中起着关键作用---通过抗体或其他方法预先阻止某些细胞因子或它们受体发挥作用可能有效阻止细胞因子风暴。但是,这些研究人员如今确定了儿茶酚胺生产在细胞因子风暴发生中的重要作用,并表明已被批准用于其他临床环境的ANP和甲酪氨酸可能有效地阻止这种并发症。一般认为,细胞因子的产生及其在免疫细胞激活中的作用有助于提高抗肿瘤免疫反应的效率。为了确保抗肿瘤作用不会减弱,在临床上测试靶向儿茶酚胺合成是否可以减少细胞因子风暴时,有必要谨慎进行。
6.Blood:揭示死亡受体信号转导对CAR-T细胞疗法发挥功能至关重要
doi:10.1182/blood.2019002121
科学家们发现了增强CAR-T细胞疗法的方法。在一项新的研究中,来自芬兰赫尔辛基大学等研究机构的研究人员发现药物分析和CRISPR-Cas9基因编辑方法为开发用于治疗白血病和淋巴瘤的CAR-T细胞疗法开辟了新途径。相关研究结果近期发表在Blood期刊上,论文标题为“Integrated drug profiling and CRISPR screening identify essential pathways for CAR T cell cytotoxicity”。
这项研究调查了500多种抗癌药物对CAR-T细胞功能的影响。这种药物分析重点关注了一类称为SMAC模拟物的药物,这类药物在实验室测试中使得癌细胞对CAR-T细胞敏感。与此同时,这项研究还发现了抑制CAR-T细胞功能的药物在治疗CAR-T细胞疗法引发的不良反应方面具有潜力。
通过采用CRISPR基因编辑方法,这些研究人员研究了哪些机制影响癌细胞对CAR-T细胞的敏感性。他们发现一种称为死亡受体信号转导(death receptor signaling)的过程和启动这种过程所需的FADD基因对于CAR-T细胞功能至关重要。这种CRISPR基因编辑方法还揭示了SMAC模拟物的作用机制是基于死亡受体信号转导的启动。
根据测试结果,SMAC模拟物可能潜在地用于进一步让癌细胞对由CAR-T细胞引起的细胞死亡敏感。如果这种初步分析中确定的药物前景得到进一步研究的支持,那么SMAC模拟物可能用来改善CAR-T细胞疗法的疗效。
7.Science:重大进展!RNA疫苗让claudin-CAR-T细胞更有效地抵抗实体瘤
doi:10.1126/science.aay5967
利用经过基因改造后表达嵌合抗原受体(CAR)的T细胞(CAR-T)进行过继性T细胞治疗已在B细胞恶性肿瘤中取得了临床成功。然而,在实体瘤患者中,CAR-T细胞疗法遭遇挑战,并不那么有 效。一个关键的障碍是允许高效根除肿瘤的癌症特异性高表达和较低脱靶毒性(off-tumor/on-target toxicity )风险的细胞表面靶标在数量上的有限性。
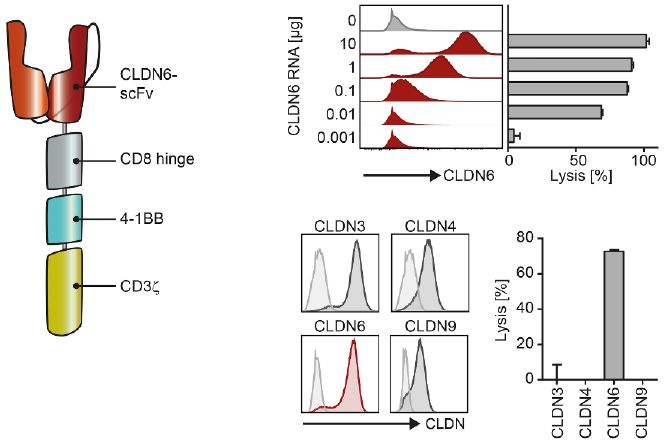
科学家们近期已报道了紧密连接蛋白6(claudin 6, CLDN6)的癌症相关表达。CLDN6是一种参与紧密连接(tight junction)形成的四跨膜蛋白。 在一项新的研究中,为了评估CLDN6是否可 作为CAR-T细胞疗法的靶标,来自德国生物制药新技术公司(Biopharmaceutical New Technologies Corporation, BioNTech)的研究人员在一套完整的人类和小鼠组织中分析了它的表达。分 析结果表明在人类中,CLDN6转录本水平在胎儿胃部、肺部和肾脏组织中较高,但在正常的成年人组织样本中检测不到。此外,与之前相一致的是,CLDN6转录本水平在诸如睾丸癌、卵巢癌、 宫颈腺癌和肺腺癌之类的多种人类癌症中通常较高。而在小鼠中,CLDN6在胎儿器官中广泛表达,但在产前发生下调,从而导致它在成年小鼠的大多数器官中缺乏表达。这就表明CLDN6是一种 严格意义上的癌胚细胞表面抗原,具有适合于CAR-T细胞靶向的理想表达谱。相关研究结果近期发表在Science期刊上,论文标题为“An RNA vaccine drives expansion and efficacy of claudin-CAR-T cells against solid tumors”。
当CLDN6-CAR-T细胞与CLDN6阳性人肿瘤细胞系共同培养时,他们观察到干扰素γ(IFNγ)分泌和T细胞活化标志物上调,但是当与CLDN6阴性肿瘤细胞共同培养时,这种情形不会发生。CLDN6 -CAR-T细胞也能够高效地清除CLDN6阳性PA-1卵巢癌球状体。通过CRISPR/Cas9敲除CLDN6可完全废除CLDN6-CAR-T细胞对PA-1卵巢癌球状体的识别,这就证实了CLDN6-CAR-T细胞的高效力和靶标 特异性。
近年来,这些研究人员通过静脉注射携带抗原编码RNA的脂质体(liposomal antigen-encoding RNA, RNA-LPX)来刺激癌症患者的天然细胞库中的肿瘤相关T细胞。这种纳米颗粒疫苗将抗原递 送到脾脏、淋巴结和骨髓中的抗原呈递细胞(APC),同时启动依赖于Toll样受体(TLR)的I型IFN驱动的免疫激活程序,从而促进抗原特异性T细胞的活化和强劲增殖。
为了验证这种方法经改进后是否可作为CAR-T细胞增强性RNA疫苗(CAR-T cell Amplifying RNA Vaccine, 简称CARVac)发挥作用,这些研究人员开展了一系列实验。首先,他们测试了CLDN6 是否在树突细胞表面上展示以便在体外刺激CLDN6-CAR-T细胞。他们检测到经过不同剂量的编码CLDN6 的RNA-LPX(简称CLDN6-LPX)处理的树突细胞表面上CLDN6的剂量依赖性表达。由此导致 的树突细胞表面上的CLDN6表达以一种剂量依赖性的方式诱导了与树突细胞共同培养的CLDN6-CAR-T细胞的激活、细胞因子分泌和增殖。在给BALB/c小鼠静脉注射CLDN6-LPX后,CLDN6表达可在 脾脏树突细胞和巨噬细胞表面上检测到,但在淋巴细胞表面上并未检测到,这就证实CLDN6在体内唯一地递送给抗原呈递细胞(比如树突细胞和巨噬细胞)。抗原呈递细胞经历成熟,而且在静 脉注射CLDN6-LPX的小鼠的脾脏和淋巴结中检测到自然杀伤细胞(NK细胞)、B细胞和T细胞受到较强的激活。
鉴于CAR-T细胞疗法的最突出的严重不良事件是细胞因子释放综合征(CRS),这些研究人员探索了CLDN6-CAR-T细胞与CARVac策略联合使用时全身性细胞因子释放发生增加的可能性。他们分析 了在接受CLDN6-CAR-T细胞移植的小鼠在接种CLDN6-LPX后的血清IFNγ、IL6和NFα水平。除了IFNγ在早期发生轻度的短暂升高之外,并未观察到受测的促炎性细胞因子经历较大的上升。此外 ,单次接种或重复接种CLDN6-LPX的小鼠的脾脏在结构上并未显示出任何明显的病理变化;在小鼠接受CLDN6-LPX重复接种后的不同时间点上,它们的脾脏的细胞组成在CD11c+树突细胞和 F4/80+巨噬细胞群体方面发生轻度的暂时性下降,而在T细胞、B细胞和NK细胞群体方面并未发生数量变化。
这些发现表明CARVac可用于改善CAR-T细胞的抗肿瘤作用。这就为利用CAR-T细胞治疗难以治疗的实体瘤提供了一种新的策略。然而,这些结果是在临床前模型中实现的,它们是否在人体中也 是如此,还有待开展进一步的研究加以验证。
8.Science子刊:重磅!我国科学家揭示CAR-T细胞触发细胞因子释放综合征机制
doi:10.1126/sciimmunol.aax7969
尽管用经过基因改造后表达嵌合抗原受体(CAR)的T细胞(CAR-T细胞)治疗B细胞恶性肿瘤的临床应用取得了成功,但是细胞因子释放综合征(CRS)却阻碍了这种疗法在患者中的有效性。众所周知,CRS是由急性炎症反应触发的,其特征是发烧、低血压和与血清细胞因子升高有关的呼吸功能不全。尽管人们已报道在经过CAR-T细胞治疗的人源化小鼠模型中,巨噬细胞参与了CRS的发病机制,但触发CRS的机制尚不清楚。输注到患者体内的CAR-T细胞经历活化和增殖,快速增殖的CAR-T细胞可能会在短时间内导致B白血病细胞迅速大量死亡。巧合的是,急性淋巴细胞白血病(ALL)患者的疾病负担也与CRS的发生率和严重程度密切相关。如此大规模的恶性B细胞死亡参与CRS发病机制的方式仍不明确。
细胞可以经历不同类型的死亡。细胞凋亡最初被认为是唯一的受到调控的程序性死亡形式。但是,近期研究已证实了一种以前未被识别的程序性坏死,其特征是细胞快速肿胀、质膜上出现较大的气泡以及促炎因子释放。至少已鉴定出两种程序性坏死细胞死亡途径,包括MLKL介导的坏死性凋亡(necroptosis)和GSDMD(Gasdermin D)或GSDME(Gasdermin E)介导的细胞焦亡(pyroptosis)。
将RIPK1招募到TNF-α受体上可与RIP3形成一种死亡复合物,随后产生膜纳米孔,从而导致坏死性凋亡。不同于MLKL的是,GSDMD或GSDME由炎性半胱天冬酶(caspase 1、caspase 4、caspase 5和小鼠caspase 11)或caspase 3激活,可产生插入到细胞膜中的寡聚物而形成纳米孔,因而介导细胞焦亡。
在一项新的研究中,来自中国医学科学院、郑州大学、华中科技大学和北京大学的研究人员提供的证据表明,人类B白血病细胞和其他靶肿瘤细胞表达了足够数量的GSDME,所表达的GSDME可被由CAR-T细胞释放的颗粒酶B激活的caspase 3高效激活,从而导致靶细胞遭受细胞焦亡。细胞焦亡释放的因子刺激巨噬细胞产生促炎性细胞因子,这很可能触发接受CAR-T细胞治疗的患者中发生的CRS。相关研究结果发表在2020年1月17日的Science Immunology期刊上,论文标题为“Gasdermin E–mediated target cell pyroptosis by CAR T cells triggers cytokine release syndrome”。
图片来自Science, 2020, doi:10.1126/science.aay5967。
这些研究人员发现CAR-T细胞由于释放大量穿孔素和颗粒酶B而激活了B白血病细胞中的caspase 3-GSDME途径,从而导致细胞焦亡和随后的CRS。已观察到CAR-T细胞经历增殖过程并在体内的某个时间点达到极高的增殖频率。因此,在相对较短的时间内,大多数靶细胞可能会经历细胞焦亡,导致受到激活的巨噬细胞通过活化的caspase 1产生IL-6和IL-1β,从而触发CRS。阐明这种分子机制为CRS严重程度与CAR-T细胞在治疗期间的数量和B白血病细胞负荷有关的临床观察提供了深刻的见解。(生物谷 Bioon.com)
这种新的治疗策略的关键之处在于识别靶细胞的被称作嵌合抗原受体(chimeric antigen receptor, CAR)的人工受体,而且在经过基因修饰后,病人T细胞能够表达这种CAR。在人体临床试验中,科学家们通过一种类似透析的过程提取出病人体内的一些T细胞,然后在实验室对它们进行基因修饰,将编码这种CAR的基因导入,这样这些T细胞就能够表达这种新的受体。这些经过基因修饰的T细胞在实验室进行增殖,随后将它们灌注回病人体内。这些T细胞利用它们表达的CAR受体结合到靶细胞表面上的分子,而这种结合触发一种内部信号产生,接着这种内部信号如此强效地激活这些T细胞以至于它们快速地摧毁靶细胞。
近年来,CAR-T免疫疗法除了被用来治疗急性白血病和非霍奇金淋巴瘤之外,经改进后,也被用来治疗实体瘤、自身免疫疾病、HIV感染和心脏病等疾病,具有更广阔的应用空间。基于此,针对CAR-T细胞疗法取得的最新进展,小编进行一番盘点,以飨读者。
1.Nat Biotechnol:为CAR-T细胞疗法设计一个紧急停止开关
doi:10.1038/s41587-019-0403-9
作为一种免疫疗法,嵌合抗原受体(CAR)T细胞(CAR-T)涉及提取患者体内的T细胞,对它们进行基因改造使得它们能够识别和杀死癌细胞。然而,当这些经过基因改造的T细胞靶向实体瘤时,它们也可以攻击健康组织,从而导致毒副作用、主要器官损伤甚至可能导致死亡。在一项新的研究中,来自瑞士洛桑联邦高等理工学院和洛桑大学等研究机构的研究人员开发出一种新的基于计算设计蛋白(computationally designed proein,即通过计算方法设计出的蛋白)的方法,可根据指令关闭这些经过基因改造的CAR-T细胞---一种为治疗反应不佳的患者设计的紧急停止开关。这种称为STOP-CAR的控制开关已在注入前列腺癌细胞的小鼠身上进行了测试和验证。这一发现可能加快以前被认为风险太大的新型CAR-T细胞疗法的临床开发。相关研究结果于2020年2月3日在线发表在Nature Biotechnology期刊上,论文标题为“A computationally designed chimeric antigen receptor provides a small-molecule safety switch for T-cell therapy”。

当癌症患者的生命遇到危险时,一种小分子可关闭CAR-T细胞,图片来自EPFL。
这种控制开关涉及将一种小分子作为单独的药物给予患者。CAR-T细胞包含一对天然结合的蛋白,这对蛋白在CAR受体和T细胞内部结构之间传递信息。这种小分子破坏了这些蛋白之间的相互作用,从而破坏了这种信号并有效地关闭了这些T细胞。
论文共同通讯作者、洛桑联邦高等理工学院生物工程研究所助理教授Bruno Correia解释道,“这种控制开关的真正优势在于如果我们停止给予这种小分子,我们就能够再次开启CAR-T细胞。如果CAR-T细胞对患者的健康构成威胁,那么它们也无需被破坏。这种控制开关使得我们能够精确控制免疫疗法的作用。”
2.Nano Lett:利用可电离的脂质纳米颗粒递送mRNA可降低CAR-T细胞疗法的毒副作用
doi:10.1021/acs.nanolett.9b04246
如今,在一项新的研究中,来自美国宾夕法尼亚大学的研究人员发现一种对T细胞毒性更小的新工程技术可以通过一种不同的机制来改变它们识别癌症的方式。利用使用这种机制的T细胞进行治疗可能给患者带来更少的副作用。相关研究结果于2020年1月17日在线发表在期刊上,论文标题为“Ionizable Lipid Nanoparticle Mediated mRNA Delivery for Human CAR T Cell Engineering”。论文通讯作者为宾夕法尼亚大学工程与应用科学学院生物工程系希尔卡尼克创新助理教授Michael Mitchell博士。论文第一作者为Mitchell实验室研究生Margaret Billingsley。
这种新工程技术涉及利用基于脂质的纳米颗粒跨过T细胞的细胞膜来递送信使RNA(mRNA),而不是使用经过基因修饰的病毒来重写T细胞的DNA。使用前一种方法将是更可取的,这是因为它只会暂时改变患者的免疫系统,但是目前让mRNA穿过细胞膜的标准方法(即电穿孔)可能会产生太大毒性,以致无法从患者体内获得所需数量的T细胞。
在体外实验中,这些研究人员发现通过他们的纳米颗粒表达CAR的T细胞在杀死癌细胞方面与目前临床使用的经过病毒基因改造的CAR-T细胞一样有效。 接下来的研究计划包括对这种递送平台的影响进行体内研究,以确定CAR瞬时表达对治疗功效和副作用的影响。
3.Cancer Discov:导致癌细胞出现CAR-T耐受性的原因
doi:10.1158/2159-8290.CD-19-0813
在最近一项研究中,宾夕法尼亚大学艾布拉姆森癌症中心的研究人员描述了癌细胞的死亡受体信号途径如何影响其对CAR T细胞的耐受性。这些发现可能为CAR T疗法受性的血液癌患者提供治疗方面指导。相关结果发表在最近的《Cancer Discovery》杂志上。
研究人员首先对称为Nalm6的ALL细胞系进行了基于全基因组CRISPR / Cas9的筛选,以分离与CAR T耐受性产生相关的信号途径。研究小组发现,在所有抗CAR T治疗的细胞中,都有细胞死亡信号途径的基因(FADD,BID,CASP8和TNFRSF10B)的活性下降的现象,而抗细胞死亡途径所需的基因(CFLAR,TRAF2和BIRC2)则表达水平较高。当他们在动物模型中对此进行测试时,其效果甚至超过了他们在体外观察到的效果。进一步,作者发现癌细胞的这些变异导致癌细胞的生存期延长以及T细胞功能障碍。
之后,该团队分析了来自患者群体中应答者和非应答者的白血病细胞和T细胞(输注前后)中的基因表达情况。他们发现,在两项临床试验中,癌细胞中的死亡受体信号传导途径与对CAR治疗的反应性直接相关,进一步表明死亡受体信号传导是ALL患者对CAR T治疗产生耐受性的关键调节因子。
4.Cancer Cell:给CAR-T细胞装上一个安全开关,可微调它们的活性
doi:10.1016/j.ccell.2019.12.014
在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员报道了关于共刺激分子调控的新发现。这些发现有可能允许人们对杀死癌症的免疫细胞---经过基因改造后表达嵌合抗原受体(CAR)的T细胞(CAR-T)---进行微调,从而提高它们杀死肿瘤的能力,或者在严重副作用的情形下降低它们的活性。相关研究结果于2020年1月30日在线发表在Cancer Cell期刊上,论文标题为“THEMIS-SHP1 Recruitment by 4-1BB Tunes LCK-Mediated Priming of Chimeric Antigen Receptor-Redirected T Cells”。论文通讯作者为北卡罗来纳大学教堂山分校莱恩伯格综合癌症中心的Gianpietro Dotti博士。

图片来自Cancer Cell, 2020, doi:10.1016/j.ccell.2019.12.014。
他们开发出对两种不同类型的经过基因修饰的T细胞进行改进的策略。这两种类型的CAR-T细胞可通过激活它们的信号来加以区分。首先,它们具有识别肿瘤上特定标志物的受体---第一个信号。它们还需要第二个信号来协助完全激活它们并增加它们的反应。这两种不同类型的T细胞需要不同的“第二信号”来激活它们。
一种类型的CAR-T细胞由CD28蛋白共同刺激,另一种类型的CAR-T细胞由4-1BB刺激。 这些研究人员希望找到一种调节这些蛋白的方法,以“微调”这些细胞的抗疾病反应,这是因为这两种类型的CAR-T细胞在体内通常持续存在多长时间来抵抗癌症、它们如何快速地作出反应以及这种反应的强度上存在差异。对于由4-1BB共同刺激的CAR-T细胞,他们发现他们可以增加LCK分子的表达,从而增加这些细胞的活性。
这些研究人员还报道了一种新的“安全开关”机制以降低由CD28共同刺激的CAR-T细胞的活性。如果患者在实验性CAR-T细胞免疫疗法中经历严重的副作用,那么医生就可能使用这种安全开关。他们发现他们可以使用一种称为SHP1的分子来降低T细胞活性。当他们添加某种药物时,SHP1会与CAR结合,从而降低CAR-T细胞的活性。
5.Nature:揭示儿茶酚胺在免疫治疗过程中引发细胞因子风暴机制
doi:10.1038/s41586-018-0774-y
许多新近开发的强效癌症疗法旨在利用靶向肿瘤的免疫反应。但是,这类免疫疗法的一个普遍问题是发生了严重的炎症反应,即细胞因子风暴(cytokine storm)。在细胞因子风暴中,称为细胞因子的蛋白的水平异常高。这会导致发烧,低血压,心脏问题,并在某些情况下导致器官衰竭和死亡。因此,人们非常有兴趣了解细胞因子风暴形成的内在机制,以便开发阻止它的方法,同时不会改变抗癌治疗的疗效。
在一项新的研究中,来自美国约翰霍普金斯大学基梅尔癌症中心和约翰霍普金斯大学医学院的研究人员揭示出蛋白ANP(atrial natriuretic peptide, 心房利钠肽)能够阻断细胞因子风暴,而且他们在免疫细胞中发现了一种自我扩增的产生环路(self-amplifying production loop),该环路产生一类称为儿茶酚胺的分子,包括肾上腺素。他们报道这种儿茶酚胺产生有助于启动和维持细胞因子风暴。相关研究结果近期发表在Nature期刊上,论文标题为“Disruption of a self-amplifying catecholamine loop reduces cytokine release syndrome”。

图片来自Nature, doi:10.1038/s41586-018-0774-y。
这些研究人员提供了令人信服的证据证实免疫细胞释放儿茶酚胺的自我扩增环路启动了细胞因子风暴。但是,确定这种环路的详细信息将需要开展进一步的研究。比如,免疫细胞的激活如何促进儿茶酚胺水平的增加,以及儿茶酚胺如何促进细胞因子的产生,这些都是未知的,应当进行研究。另一个谜团是哪种类型的肾上腺素能受体对于儿茶酚胺对人体细胞因子水平的影响至关重要。ANP具有抗炎特性,但是它如何抑制儿茶酚胺产生是另一个未解决的关键问题,这值得进一步开展研究。
这些发现可能会导致在免疫疗法中开发出应对细胞因子风暴的新策略。 CAR-T细胞免疫疗法的小鼠模型表明髓样细胞的激活在驱动细胞因子风暴中起着关键作用---通过抗体或其他方法预先阻止某些细胞因子或它们受体发挥作用可能有效阻止细胞因子风暴。但是,这些研究人员如今确定了儿茶酚胺生产在细胞因子风暴发生中的重要作用,并表明已被批准用于其他临床环境的ANP和甲酪氨酸可能有效地阻止这种并发症。一般认为,细胞因子的产生及其在免疫细胞激活中的作用有助于提高抗肿瘤免疫反应的效率。为了确保抗肿瘤作用不会减弱,在临床上测试靶向儿茶酚胺合成是否可以减少细胞因子风暴时,有必要谨慎进行。
6.Blood:揭示死亡受体信号转导对CAR-T细胞疗法发挥功能至关重要
doi:10.1182/blood.2019002121
科学家们发现了增强CAR-T细胞疗法的方法。在一项新的研究中,来自芬兰赫尔辛基大学等研究机构的研究人员发现药物分析和CRISPR-Cas9基因编辑方法为开发用于治疗白血病和淋巴瘤的CAR-T细胞疗法开辟了新途径。相关研究结果近期发表在Blood期刊上,论文标题为“Integrated drug profiling and CRISPR screening identify essential pathways for CAR T cell cytotoxicity”。
这项研究调查了500多种抗癌药物对CAR-T细胞功能的影响。这种药物分析重点关注了一类称为SMAC模拟物的药物,这类药物在实验室测试中使得癌细胞对CAR-T细胞敏感。与此同时,这项研究还发现了抑制CAR-T细胞功能的药物在治疗CAR-T细胞疗法引发的不良反应方面具有潜力。
通过采用CRISPR基因编辑方法,这些研究人员研究了哪些机制影响癌细胞对CAR-T细胞的敏感性。他们发现一种称为死亡受体信号转导(death receptor signaling)的过程和启动这种过程所需的FADD基因对于CAR-T细胞功能至关重要。这种CRISPR基因编辑方法还揭示了SMAC模拟物的作用机制是基于死亡受体信号转导的启动。
根据测试结果,SMAC模拟物可能潜在地用于进一步让癌细胞对由CAR-T细胞引起的细胞死亡敏感。如果这种初步分析中确定的药物前景得到进一步研究的支持,那么SMAC模拟物可能用来改善CAR-T细胞疗法的疗效。
7.Science:重大进展!RNA疫苗让claudin-CAR-T细胞更有效地抵抗实体瘤
doi:10.1126/science.aay5967
利用经过基因改造后表达嵌合抗原受体(CAR)的T细胞(CAR-T)进行过继性T细胞治疗已在B细胞恶性肿瘤中取得了临床成功。然而,在实体瘤患者中,CAR-T细胞疗法遭遇挑战,并不那么有 效。一个关键的障碍是允许高效根除肿瘤的癌症特异性高表达和较低脱靶毒性(off-tumor/on-target toxicity )风险的细胞表面靶标在数量上的有限性。
科学家们近期已报道了紧密连接蛋白6(claudin 6, CLDN6)的癌症相关表达。CLDN6是一种参与紧密连接(tight junction)形成的四跨膜蛋白。 在一项新的研究中,为了评估CLDN6是否可 作为CAR-T细胞疗法的靶标,来自德国生物制药新技术公司(Biopharmaceutical New Technologies Corporation, BioNTech)的研究人员在一套完整的人类和小鼠组织中分析了它的表达。分 析结果表明在人类中,CLDN6转录本水平在胎儿胃部、肺部和肾脏组织中较高,但在正常的成年人组织样本中检测不到。此外,与之前相一致的是,CLDN6转录本水平在诸如睾丸癌、卵巢癌、 宫颈腺癌和肺腺癌之类的多种人类癌症中通常较高。而在小鼠中,CLDN6在胎儿器官中广泛表达,但在产前发生下调,从而导致它在成年小鼠的大多数器官中缺乏表达。这就表明CLDN6是一种 严格意义上的癌胚细胞表面抗原,具有适合于CAR-T细胞靶向的理想表达谱。相关研究结果近期发表在Science期刊上,论文标题为“An RNA vaccine drives expansion and efficacy of claudin-CAR-T cells against solid tumors”。
当CLDN6-CAR-T细胞与CLDN6阳性人肿瘤细胞系共同培养时,他们观察到干扰素γ(IFNγ)分泌和T细胞活化标志物上调,但是当与CLDN6阴性肿瘤细胞共同培养时,这种情形不会发生。CLDN6 -CAR-T细胞也能够高效地清除CLDN6阳性PA-1卵巢癌球状体。通过CRISPR/Cas9敲除CLDN6可完全废除CLDN6-CAR-T细胞对PA-1卵巢癌球状体的识别,这就证实了CLDN6-CAR-T细胞的高效力和靶标 特异性。
近年来,这些研究人员通过静脉注射携带抗原编码RNA的脂质体(liposomal antigen-encoding RNA, RNA-LPX)来刺激癌症患者的天然细胞库中的肿瘤相关T细胞。这种纳米颗粒疫苗将抗原递 送到脾脏、淋巴结和骨髓中的抗原呈递细胞(APC),同时启动依赖于Toll样受体(TLR)的I型IFN驱动的免疫激活程序,从而促进抗原特异性T细胞的活化和强劲增殖。
为了验证这种方法经改进后是否可作为CAR-T细胞增强性RNA疫苗(CAR-T cell Amplifying RNA Vaccine, 简称CARVac)发挥作用,这些研究人员开展了一系列实验。首先,他们测试了CLDN6 是否在树突细胞表面上展示以便在体外刺激CLDN6-CAR-T细胞。他们检测到经过不同剂量的编码CLDN6 的RNA-LPX(简称CLDN6-LPX)处理的树突细胞表面上CLDN6的剂量依赖性表达。由此导致 的树突细胞表面上的CLDN6表达以一种剂量依赖性的方式诱导了与树突细胞共同培养的CLDN6-CAR-T细胞的激活、细胞因子分泌和增殖。在给BALB/c小鼠静脉注射CLDN6-LPX后,CLDN6表达可在 脾脏树突细胞和巨噬细胞表面上检测到,但在淋巴细胞表面上并未检测到,这就证实CLDN6在体内唯一地递送给抗原呈递细胞(比如树突细胞和巨噬细胞)。抗原呈递细胞经历成熟,而且在静 脉注射CLDN6-LPX的小鼠的脾脏和淋巴结中检测到自然杀伤细胞(NK细胞)、B细胞和T细胞受到较强的激活。
鉴于CAR-T细胞疗法的最突出的严重不良事件是细胞因子释放综合征(CRS),这些研究人员探索了CLDN6-CAR-T细胞与CARVac策略联合使用时全身性细胞因子释放发生增加的可能性。他们分析 了在接受CLDN6-CAR-T细胞移植的小鼠在接种CLDN6-LPX后的血清IFNγ、IL6和NFα水平。除了IFNγ在早期发生轻度的短暂升高之外,并未观察到受测的促炎性细胞因子经历较大的上升。此外 ,单次接种或重复接种CLDN6-LPX的小鼠的脾脏在结构上并未显示出任何明显的病理变化;在小鼠接受CLDN6-LPX重复接种后的不同时间点上,它们的脾脏的细胞组成在CD11c+树突细胞和 F4/80+巨噬细胞群体方面发生轻度的暂时性下降,而在T细胞、B细胞和NK细胞群体方面并未发生数量变化。
这些发现表明CARVac可用于改善CAR-T细胞的抗肿瘤作用。这就为利用CAR-T细胞治疗难以治疗的实体瘤提供了一种新的策略。然而,这些结果是在临床前模型中实现的,它们是否在人体中也 是如此,还有待开展进一步的研究加以验证。
8.Science子刊:重磅!我国科学家揭示CAR-T细胞触发细胞因子释放综合征机制
doi:10.1126/sciimmunol.aax7969
尽管用经过基因改造后表达嵌合抗原受体(CAR)的T细胞(CAR-T细胞)治疗B细胞恶性肿瘤的临床应用取得了成功,但是细胞因子释放综合征(CRS)却阻碍了这种疗法在患者中的有效性。众所周知,CRS是由急性炎症反应触发的,其特征是发烧、低血压和与血清细胞因子升高有关的呼吸功能不全。尽管人们已报道在经过CAR-T细胞治疗的人源化小鼠模型中,巨噬细胞参与了CRS的发病机制,但触发CRS的机制尚不清楚。输注到患者体内的CAR-T细胞经历活化和增殖,快速增殖的CAR-T细胞可能会在短时间内导致B白血病细胞迅速大量死亡。巧合的是,急性淋巴细胞白血病(ALL)患者的疾病负担也与CRS的发生率和严重程度密切相关。如此大规模的恶性B细胞死亡参与CRS发病机制的方式仍不明确。
细胞可以经历不同类型的死亡。细胞凋亡最初被认为是唯一的受到调控的程序性死亡形式。但是,近期研究已证实了一种以前未被识别的程序性坏死,其特征是细胞快速肿胀、质膜上出现较大的气泡以及促炎因子释放。至少已鉴定出两种程序性坏死细胞死亡途径,包括MLKL介导的坏死性凋亡(necroptosis)和GSDMD(Gasdermin D)或GSDME(Gasdermin E)介导的细胞焦亡(pyroptosis)。
将RIPK1招募到TNF-α受体上可与RIP3形成一种死亡复合物,随后产生膜纳米孔,从而导致坏死性凋亡。不同于MLKL的是,GSDMD或GSDME由炎性半胱天冬酶(caspase 1、caspase 4、caspase 5和小鼠caspase 11)或caspase 3激活,可产生插入到细胞膜中的寡聚物而形成纳米孔,因而介导细胞焦亡。
在一项新的研究中,来自中国医学科学院、郑州大学、华中科技大学和北京大学的研究人员提供的证据表明,人类B白血病细胞和其他靶肿瘤细胞表达了足够数量的GSDME,所表达的GSDME可被由CAR-T细胞释放的颗粒酶B激活的caspase 3高效激活,从而导致靶细胞遭受细胞焦亡。细胞焦亡释放的因子刺激巨噬细胞产生促炎性细胞因子,这很可能触发接受CAR-T细胞治疗的患者中发生的CRS。相关研究结果发表在2020年1月17日的Science Immunology期刊上,论文标题为“Gasdermin E–mediated target cell pyroptosis by CAR T cells triggers cytokine release syndrome”。

图片来自Science, 2020, doi:10.1126/science.aay5967。
这些研究人员发现CAR-T细胞由于释放大量穿孔素和颗粒酶B而激活了B白血病细胞中的caspase 3-GSDME途径,从而导致细胞焦亡和随后的CRS。已观察到CAR-T细胞经历增殖过程并在体内的某个时间点达到极高的增殖频率。因此,在相对较短的时间内,大多数靶细胞可能会经历细胞焦亡,导致受到激活的巨噬细胞通过活化的caspase 1产生IL-6和IL-1β,从而触发CRS。阐明这种分子机制为CRS严重程度与CAR-T细胞在治疗期间的数量和B白血病细胞负荷有关的临床观察提供了深刻的见解。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


