2021年4月30日Science期刊精华,我国科学家同期发表两篇Science论文
来源:本站原创 2021-04-30 23:54
2021年4月30日讯/生物谷BIOON/---本周又有一期新的Science期刊(2021年4月30日)发布,它有哪些精彩研究呢?让小编一一道来。1.Science:重大突破!千万不要单个拆散,不然我就投毒!我国科学家揭示CRISPR-Cas系统对宿主细胞成瘾机制doi:10.1126/science.abe5601在目前的基因组序列数据库中,约40%的细
2021年4月30日讯/生物谷BIOON/---本周又有一期新的Science期刊(2021年4月30日)发布,它有哪些精彩研究呢?让小编一一道来。

图片来自Science期刊。
1.Science:重大突破!千万不要单个拆散,不然我就投毒!我国科学家揭示CRISPR-Cas系统对宿主细胞成瘾机制
doi:10.1126/science.abe5601
在目前的基因组序列数据库中,约40%的细菌和约90%的古细菌基因组携带CRISPR-Cas位点,这表明除了适应性免疫的直接益处外,可能还存在减轻CRISPR系统的成本并防止其损失的机制。在一项新的研究中,来自中国科学院、中国科学院大学和四川师范大学等研究机构的研究人员特别研究了一种古细菌I-B型CRISPR-Cas系统,它包括一个长311个碱基对(bp)的基因间区域,在这种系统中,编码CRISPR效应物Cascade亚基的基因不能单独剔除,但可以很容易地作为一个整体剔除。这些观察结果表明,Cascade基因盒(cas6-cas8-cas7-cas5)包括一个有毒成分,使其对宿主成瘾(一旦任何一个cascade基因被剔除就会引起细胞毒性)。相关研究结果发表在2021年4月30日的Science期刊上,论文标题为“Toxin-antitoxin RNA pairs safeguard CRISPR-Cas systems”。
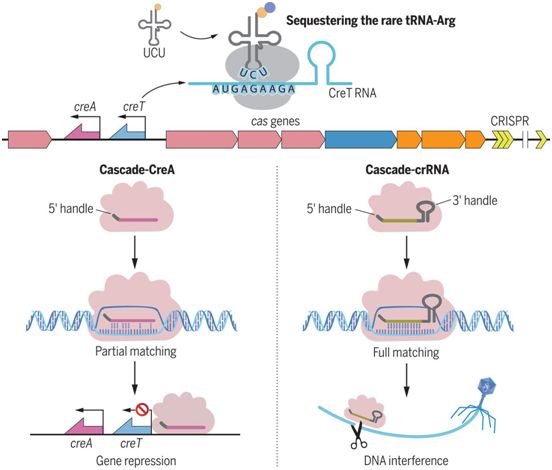
毒素-抗毒素RNA对CreTA保护CRISPR-Cas,图片来自Science, 2021, doi:10.1126/science.abe5601。
cas6和cas8之间的这个基因间序列在缺乏一个或多个cascade基因的细胞中引起毒性。通过广泛的突变分析,这些作者确定了RNA毒素基因creT及其关键序列元件,即一个强大的Shine-Dalgarno基序、一个有效的起始密码子、两个紧靠下游的小精氨酸密码子(AGA)和一个稳定的茎环结构的组合。tRNAUCU的过量表达缓解了CreT的毒性,这就支持一种机制,即这种RNA毒素通过隔绝稀少的精氨酸tRNAUCU来阻止细胞生长。
对CreT及其相邻序列的突变分析显示,相邻的CRISPR重复序列样序列是抑制CreT毒性所必需的。这个CRISPR重复序列样序列之后紧接着是一个间隔序列样序列(spacer-like sequence)和一个转录终止子。通过Northern印迹和RNA测序,这些作者证实了CreA RNA---一种缺乏3′柄的CRISPR RNA变体---的表达。CreA的间隔序列样序列与creT的启动子(PcreT)部分匹配,而且通过使用一个报告基因,他们证实当与Cascade形成复合物时,CreA抑制PcreT。与CRISPR干扰类似的是,对creT的抑制需要间隔序列邻近基序(protospacer adjacent motif, PAM)和PAM-近端碱基配对。在缺乏CreTA的细胞中,cascade基因容易受到转座因子的破坏。他们的生物信息学分析确定了多个与不同的古细菌和细菌CRISPR-cas位点相关并且含有与各自CRISPR系统相对应的PAM的CreTA类似物。值得注意的是,这些CreTA类似物在核酸序列上几乎没有保守性,这表明它们已经高度分歧地进化,因此可以想象,它们利用了不同的毒性机制。
2.Science:我国科学家从结构上揭示预起始复合物在核心启动子上的组装机制
doi:10.1126/science.aba8490
RNA聚合酶II(Pol II)介导的转录起始需要组装一种预起始复合物(preinitiation complex, PIC),在此期间,14个亚基的转录因子IID(TFIID)识别核心启动子并招募TFIIA、TFIIB、TFIIE、TFIIF、TFIIH和Pol II,依次组装核心PIC(core PIC, cPIC)、中间PIC(intermediate PIC, mPIC)和全PIC(holo PIC, hPIC)。教科书上的转录起始模型是从TBP(TATA框结合蛋白,TFIID的一个亚基)与TATA框的结合开始的。然而,多达85%的编码基因缺乏共有的TATA框,而且几乎所有Pol II介导的基因转录都需要TFIID复合物。尽管对基于TBP的PIC在TATA框启动子上进行了广泛的结构研究,但TFIID如何支持PIC在不同启动子上的组装仍然是不清楚的。
在一项新的研究中,来自中国复旦大学的研究人员重建了基于TFIID的人PIC,并解析出它的低温电镜结构。在13个不同的(天然的、复合的和突变的)启动子上,通过25种处于不同组成和构象状态的复合物结构来描述PIC的逐步组装。Pol II、TFIID模块和TBP-启动子在近原子分辨率下的结构允许进行详细的结构分析。相关研究结果发表在2021年4月30日的Science期刊上,论文标题为“Structural insights into preinitiation complex assembly on core promoters”。
不同构象下的结构显示了一种共同的TFIID结合模式,以及TBP加载在TATA框启动子(TATA promoter)和无TATA框的启动子(TATA-less promoter)上。出乎意料的是,TBP在PIC中类似地让TATA框和无TATA框的启动子弯曲。不同启动子上的PIC组装在cPIC处分化为两条轨道,在hPIC处汇合。在第一轨道上,TATA-DBE启动子上的cPIC、mPIC和hPIC分别采用Park、Neutral和Drive构象,表明启动子逐步沉积到Pol II,并伴随着广泛的模块重组。在第二轨道上,纯TATA框启动子(TATA-only promoter)和无TATA框启动子上的cPIC、mPIC和hPIC采用Drive构象,表明发生直接启动子沉积。
这些差异来自不同的启动子组成,导致启动子上“匹配”的模块与“重新定位”的模块分离,并导致不同的PIC结构和启动子轨迹。在hPIC中,TFIID稳定化PIC组装,支持细胞周期蛋白依赖性激酶7(CDK7)加载到Pol II上和CDK7介导的羧基端结构域(CTD)磷酸化。
3.Science:揭示脓肿分枝杆菌的逐步致病性进化
doi:10.1126/science.abb8699; doi:10.1126/science.abi5695
目前,CF患者中超过70%的感染是由遗传上簇集(并因此传播)的分离株引起的,其中大部分来自过去50年内出现并已在全球范围内传播的三个优势循环克隆(dominant circulating clone, DCC)。这些簇集的分离株在体外和体内测试时毒性更强,并导致更糟糕的临床结果,这表明它们正在从环境腐生菌演变为专性肺部病原菌。在一项新的研究中,英国研究人员推断,对脓肿分枝杆菌的功能基因组分析可能会鉴定出这一进化轨迹中重要的可推广的步骤,并强调潜在的干预措施,以减轻这一过程对这种分枝杆菌和其他新出现的分枝杆菌病原菌的影响。相关研究结果发表在2021年4月30日的Science期刊上,论文标题为“Stepwise pathogenic evolution of Mycobacterium abscessus”。
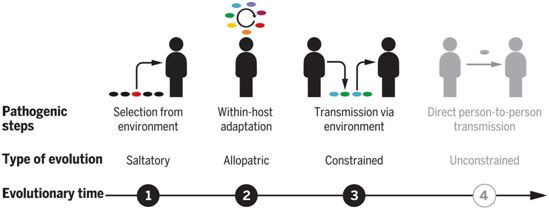
分支杆菌致病性进化的步骤,图片来自Science, 2021, doi:10.1126/science.abb8699。
接下来,这些作者研究了感染性脓肿分枝杆菌克隆的持续适应性是否能进一步促进致病性。他们重建了长期感染的患者体内单个脓肿分枝杆菌亚克隆的进化轨迹,发现个体内部和个体之间的趋同异域进化(convergent allopatric evolution)是致病性适应的关键驱动力。具体来说,来自单一功能网络的一小部分基因中的频发突变可能会驱动巨噬细胞生存能力的增强和体内毒力的增加。
这些作者观察到许多适应性突变的传播适应性降低。对于两个经常突变的基因(phoR和GPL基因座),基因敲除脓肿分枝杆菌显示出在病媒的生存能力受损。这些发现表明,宿主内部的进化受到限制,而传播需要一个环境中介。
4.1篇Science+2篇Science子刊论文同日发表,揭示HIV候选疫苗有效之谜
doi:10.1126/science.abe9233; doi:10.1126/sciimmunol.abg1703; doi:10.1126/sciimmunol.abg5413
在首次设计出一种新型的基于恒河猴巨细胞病毒毒株68-1(RhCMV)的疫苗约二十年后,来自美国俄勒冈健康与科学大学的研究人员正在解开为什么它能在大约一半非人类灵长类动物中阻止并最终清除HIV的猴子版本(称为SIV),以及为什么它是阻止人类感染HIV的一种有希望的候选疫苗。
在2021年3月25日,这些构建RhCMV疫苗平台的研究人员描述了它发挥作用的不寻常的生物机制。相关研究结果以一篇Science论文(下称第一篇论文)和两篇Science Immunology论文(下称第二篇论文和第三篇论文)的形式发表,论文标题分别为“Modulation of MHC-E transport by viral decoy ligands is required for RhCMV/SIV vaccine efficacy”、“HLA-E–restricted, Gag-specific CD8+ T cells can suppress HIV-1 infection, offering vaccine opportunities”和“Cytomegaloviral determinants of CD8+ T cell programming and RhCMV/SIV vaccine efficacy”。
这些发现也有助于对在俄勒冈健康与科学大学开发的基于人CMV(HCMV)的HIV实验性疫苗(称为VIR-1111)进行微调,其中VIR-1111如今正在进行1期临床试验评估。该临床试验由Vir生物技术公司开展,该公司从俄勒冈健康与科学大学获得巨细胞病毒(CMV)疫苗平台技术许可。
5.Science:更稳定的刺突蛋白解释了新冠病毒D614G变种更快传播
doi:10.1126/science.abf2303; doi:10.1126/science.abi4711
快速传播的英国、南非和巴西冠状病毒SARS-CoV-2变体引起了人们对COVID-19疫苗是否能保护他们的关注和质疑。在一项新的研究中,来自美国波士顿儿童医院和哈佛医学院等研究机构的研究人员分析了SARS-CoV-2刺突蛋白的结构如何随着D614G突变---所有三种变体所携带的一种突变---发生变化,并显示了为什么这些变体能够更快地传播。相关研究结果于2021年3月16日在线发表在Science期刊上,论文标题为“Structural impact on SARS-CoV-2 spike protein by D614G substitution”。论文通讯作者为波士顿儿童医院的Bing Chen博士。
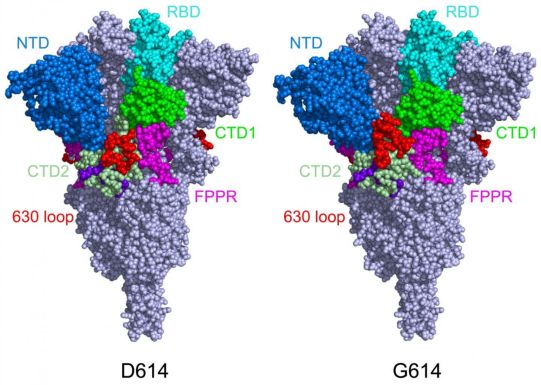
图片来自Science, 2021, doi:10.1126/science.abf2303。
Chen和他的同事们正在进一步应用结构生物学来更好地理解SARS-CoV-2如何与ACE2受体结合,并着眼于开发阻止病毒进入我们的细胞的治疗方法。
6.三篇Science论文揭示噬菌体基因组中二氨基嘌呤取代腺嘌呤被整入到病毒基因组中
doi:10.1126/science.abe4882; doi:10.1126/science.abe6494; doi:10.1126/science.abe6542; doi:10.1126/science.abh3571
四个核碱基---腺嘌呤(A)、胞嘧啶(C)、鸟嘌呤(G)和胸腺嘧啶(T)---通常被认为在DNA中是不变的。然而,在s噬菌体中,每个DNA碱基都有变化,从而帮助它们逃避细菌限制性酶的降解。在噬蓝藻体(cyanophage)S-2L的基因组中,A被二氨基嘌呤(Z)完全取代,Z与T形成三个氢键,从而在这种病毒的DNA中形成了非Watson-Crick碱基配对。Zhou等人和Sleiman等人确定了产生Z的生化途径,这揭示了在环境和系统发育中广泛分布的细菌中容纳的病毒含有更多的Z基因组(即A被Z完全取代的基因组)。Pezo等人鉴定出一种DNA聚合酶,它将Z整入DNA,同时阻止A整入DNA。这些发现丰富了我们对生物多样性的理解,并扩大了合成生物学的基因调色板。
7.Science:在哥伦布地理大发现之前,广泛的重新造林对二氧化碳的影响
doi:10.1126/science.abf3870
17世纪初全球大气中二氧化碳(CO2)水平的暂时降低现在被归因于亚马逊地区在欧洲入侵者带来的疾病造成原住民的灾难性生命损失之后的重新造林。Bush等人利用过去一千年从亚马逊湖沉积物中提取的花粉化石数据发现,森林恢复是在人口崩溃前300到600年开始的。最近大气中二氧化碳的低谷与当时的快速重新造林没有关系。植被的变化似乎是欧洲人到来之前的几个世纪里土地使用模式的变化以及由此造成的破坏的结果,而二氧化碳下降的原因仍然是个谜。
8.Science:探究人类对岛屿生态系统的影响
doi:10.1126/science.abd6706
海洋岛屿是地球上最近被人类殖民的地区之一,在许多情况下,只是在过去几千年里。因此,它们是研究人类对自然植被和生物多样性影响的重要实验室。Nogué等人对全世界27个岛屿进行了定量古生态学研究,着重关注人类到来之前和之后的植被组成的花粉记录。这些作者发现,在人类入侵后,植被更替加速的模式是一致的,变化率的中位数增加了6倍。这些变化的发生与岛屿的地理和生态特征无关,并显示了生态系统的变化有多快,以及岛屿生态系统如何被设定在新的轨道上。
9.Science:野生马科动物挖井改善旱地生态系统的水可用性
doi:10.1126/science.abd6775
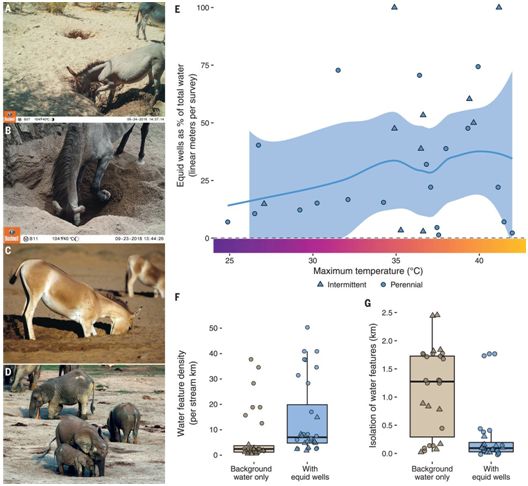
打井增加了沙漠溪流的可用水量,图片来自Science, 2021, doi:10.1126/science.abd6775。
水在旱地生态系统中是稀缺的。这些地区的一些大型动物挖井,可能为其他物种提供水。这种行为可能在现在已经灭绝的巨型动物中很常见,特别是在北美和南美,那里的巨型动物灭绝最为严重。Lundgren等人测试了重新引入北美西南部沙漠地区的野生马科动物(马和驴)是否会挖井,以提供生态系统层面的好处。他们发现,马科动物挖的井增加了水的可用性,被大量的物种使用,并减少了水源之间的距离。废弃的水井也导致了关键的河岸树种的发芽率增加。这样的马科动物挖的水井改善了水的可用性,也许取代了失去的巨型动物功能。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


