2021年11月Cell期刊不得不看的亮点研究
来源:本站原创 2021-11-30 23:42
2021年11月30日讯/生物谷BIOON/---2021年11月份即将结束了,11月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。1.Cell:新研究表明新冠病毒并不感染人类嗅球神经元,但能感染嗅觉上皮的支柱细胞doi:10.1016/j.cell.2021.10.027如今人们普遍知道,COVID-19与嗅觉的短暂或长期丧失有
2021年11月30日讯/生物谷BIOON/---2021年11月份即将结束了,11月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:新研究表明新冠病毒并不感染人类嗅球神经元,但能感染嗅觉上皮的支柱细胞
doi:10.1016/j.cell.2021.10.027
如今人们普遍知道,COVID-19与嗅觉的短暂或长期丧失有关,但其机制仍然不清楚。一个尚未解决的问题是嗅觉神经是否能够为SARS-CoV-2提供进入大脑的途径。在一项新的研究中,来自德国马克斯-普朗克神经遗传学研究室和比利时鲁汶大学等研究机构的研究人员报告说,SARS-CoV-2似乎没有感染COVID-19患者的嗅觉上皮的感觉神经元。此外,他们未能找到这种病毒感染嗅球神经元的证据。相反,支柱细胞(sustentacular cell)是它在嗅觉上皮的主要靶细胞类型。鉴于SARS-CoV2放过了嗅感觉神经元(olfactory sensory neuron)和嗅球神经元,它似乎不是一种嗜神经病毒。相关研究结果发表在2021年11月24日的Cell期刊上,论文标题为“Visualizing in deceased COVID-19 patients how SARS-CoV-2 attacks the respiratory and olfactory mucosae but spares the olfactory bulb”。
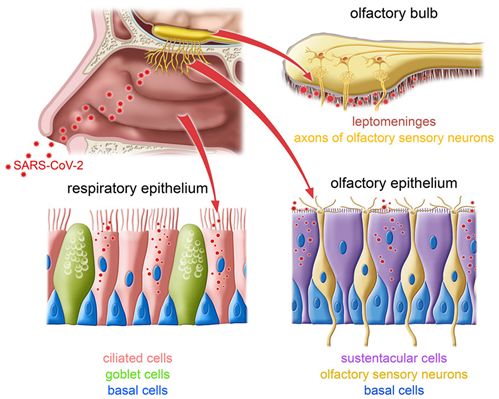
图片来自Cell, 2021, doi:10.1016/j.cell.2021.10.027。
这些作者使用专门设计的探针对这些组织样本的切片进行染色,并在共聚焦显微镜下对其进行分析。这种超灵敏的分析方法---称为RNAscope---使得在单细胞内可视化观察SARS-CoV-2的多种类型的RNA分子成为可能。他们能够通过同时用不同的颜色观察多种细胞类型所特有的RNA分子,并结合使用抗体的经典细胞染色方法,将受感染的细胞分配到特定的细胞类型。论文共同通讯作者、马克斯-普朗克神经遗传学研究室主任Peter Mombaerts说,“我们的结果表明,SARS-CoV-2感染了COVID-19患者嗅觉上皮的支柱细胞,并在这些细胞中进行了强有力的复制。”
2.Cell:科学家成功设计出一种新型的毒蕈碱M1受体激动剂 有望潜在治疗阿尔兹海默病
doi:10.1016/j.cell.2021.11.001
目前治疗阿尔兹海默病的方法是通过抑制乙酰胆碱酯酶来预防乙酰胆碱的分解,从而有效纠正有缺陷的胆碱能的传递,然而这些方法的临床疗效非常有限;另一种方法就是直接激活负责学习和记忆的胆碱能受体,M1-毒蕈碱乙酰胆碱(M1,M1-muscarinic acetylcholine)受体就是首选的靶点,但其应用一直受到了不良负面作用的阻碍。近日,一篇发表在国际杂志Cell上题为“From structure to clinic: Design of a muscarinic M1 receptor agonist with potential to treatment of Alzheimer’s disease”的研究报告中,来自格拉斯哥大学等机构的科学家们通过研究取得了从实验室到床边的突破性发现,他们希望相关研究结果能推动开发治疗阿尔兹海默病患者的新型疗法。
这篇研究报告中,研究人员首次描述了设计一种新型分子的过程,在实验室临床前和人类临床研究中,这种分子能选择性地靶向作用大脑中的特殊受体蛋白,这种新方法或许展现出了在开发新型药物来改善阿尔兹海默病患者大脑认知功能方面的潜力。目前并没有任何药物能组织或减缓阿尔兹海默病的进展,然而有一些药物却能恢复早期痴呆症患者的记忆缺失并改善其认知功能,但这些药物通常并不有效,而且还会产生一定的副作用,这或许就限制了其在临床实践中的应用。
研究人员重点关注的这种分子能选择性靶向作用大脑中名为M1-毒蕈碱乙酰胆碱受体(M1受体)的受体分子,其在机体记忆和认知功能发挥过程中扮演着重要角色,随后的转化医学研究检测了一种假设,即诸如此类分子是否能保留认知效益并缺乏剂量限制的副作用。通过密切合作后,研究人员表示,尽管M1受体与其它类型的毒蕈碱受体非常相似,但利用对M1受体3D结构的详细理解,他们有望成功设计出一种选择性极强的调节自,这种方法称之为基于结构的药物设计或SBDD。
随后的临床前研究证实,所设计的分子能够保留改善记忆的最佳特性,同时还能最大限度地减少与此前尝试靶向作用M1受体所产生的副作用。临床研究表明,M1选择性候选临床药物HTL9936,在健康志愿者的有意义剂量下显示出了副作用的降低。这些研究成果证实了研究人员利用受体3D结构所开发的新方法的假设和剂量,其或有望应用于M1受体来帮助开发治疗阿尔兹海默病的新型药物疗法,并具有一定的意义来突出解决与多种疾病相关的其它GPCRs的新方法。
3.Cell:揭示哺乳动物自噬体形成机制,新冠病毒可以破坏这种机制
doi:10.1016/j.cell.2021.10.017
一种称为自噬的错综复杂的生物过程通过清除和回收碎片和入侵的微生物,在保持我们的细胞健康和功能方面发挥着重要作用。在此之前,人们对对自噬的了解大多是基于对酵母细胞的研究。
如今,在一项新的研究中,美国新墨西哥大学自噬、炎症与代谢卓越生物医学研究中心主任Vojo Deretic教授领导的一个研究团队绘制出了自噬在哺乳动物---包括人类---中如何发挥作用的关键细节。在一项令人惊人的发现中,这些作者提供的证据显示,SARS-CoV-2感染可以破坏这一过程。相关研究结果近期发表在Cell期刊上,论文标题为“Mammalian hybrid pre-autophagosomal structure HyPAS generates autophagosomes”。
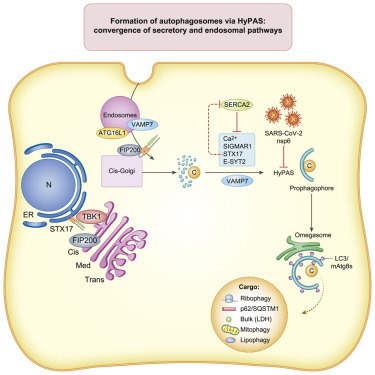
图片来自Cell, 2021, doi:10.1016/j.cell.2021.10.017。
Deretic说,他们惊讶地发现SARS-CoV-2冠状病毒会干扰自噬过程。Deretic说,细胞有强大的先天免疫机制来识别试图在其内部细胞质中复制的病毒,但是这种冠状病毒已经找到了一种偷偷摸摸的方式进行增殖。
4.Cell:类似于Delta变体的SARS-CoV-2变体最可能增加COVID-19大流行的严重性
doi:10.1016/j.cell.2021.11.026
在一项新的研究中,来自美国哈佛大学陈曾熙公共卫生学院的研究人员构建出一种数学模型,发现具有与Delta变体相似特征的SARS-CoV-2变体---增强了传播性和感染以前感染/接种过疫苗的人的能力---将引起更严重的大流行病,与单独具有这两种特征之一的SARS-CoV-2变体相比,导致更多的感染和突破性感染/再感染。这些发现有可能帮助科学家们和公共卫生官员解释新变体和现有变体的重要性,并根据变体的特征为各种情况设计有针对性的公共卫生对策。相关研究结果于2021年11月18日在线发表在Cell期刊上,论文标题为“Population impact of SARS-CoV-2 variants with enhanced transmissibility and/or partial immune escape”。
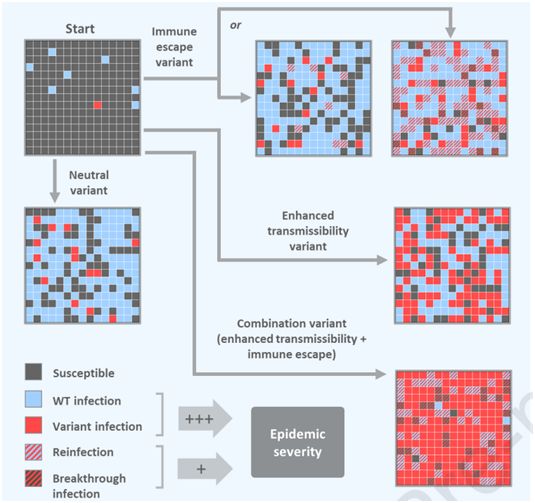
图片来自Cell, 2021, doi:10.1016/j.cell.2021.11.026。
该分析模拟了COVID-19大流行的几种不同的假设变体,这些变体包括两种特征的多种组合:增强的传播性,类似于Alpha变体;部分免疫逃逸,类似于Beta变体;增强的传播性和部分免疫逃逸,类似于Delta变体;以及不具备这两种特征中任何一种的变体。该分析还考虑了某些变量,如戴口罩/物理距离或疫苗接种,将如何影响COVID-19大流行的轨迹。对于每一种情形,这些作者都分析了感染的总人数,以及通过接种疫苗避免的感染人数所占的百分比。
Bushman及其团队确定,仅具有增强的传播性的变体就可能比能够部分逃避免疫系统的变体更危险。然而,具有这两种特征的变体可能比单独具有其中任何一种特征的变体造成更多的感染、再感染和突破性感染。
5.Cell:新研究构建出人类基因组中的单细胞染色质图谱
doi:10.1016/j.cell.2021.10.024
在一项新的研究中,来自美国加州大学圣地亚哥分校的研究人员为人类基因组构建出单细胞染色质图谱。染色质是真核细胞中发现的由DNA和蛋白组成的复合物;在某些细胞核内,关键基因调控元件所在的染色质区域以开放的结构出现。在不同人类组织类型的细胞中精确地确定这些可访问的染色质区域将是理解基因调控元件(非编码DNA)在人类健康或疾病中的作用的重要一步。相关研究结果于2021年11月12日在线发表在Cell期刊上,论文标题为“A single-cell atlas of chromatin accessibility in the human genome”。
在对小鼠进行研究后,Ren及其合作者将注意力转向人类基因组中染色质的单细胞图谱。他们对来自多个捐赠者的30种成年人类组织类型的60多万个人类细胞进行了检测,然后将这些信息与来自15种胎儿组织类型的类似数据结合起来,揭示了222种不同细胞类型中大约120万个候选顺式调控元件的染色质状态。
Ren说,这些新的发现为240种多基因性状和疾病确定了疾病特征相关的细胞类型,并注释了非编码DNA变异的风险。“我们相信,这一资源将在未来许多年里大大促进一系列人类疾病的机制研究。”
6.Cell:揭示在卵子和精子形成过程中发生基因突变的新机制
doi:10.1016/j.cell.2021.10.025
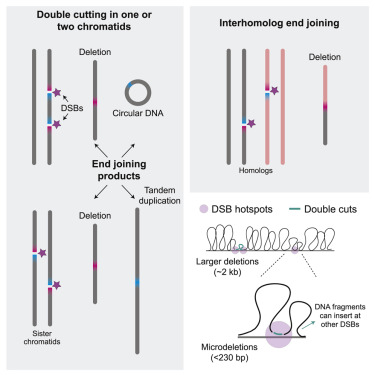
图片来自Cell, 2021, doi:10.1016/j.cell.2021.10.025。
在这项新的研究中,Jasin及其团队专注于缺少一个名为ATM的基因的雄性小鼠。ATM的突变与癌症有关,因为它们使细胞无法识别受损的DNA,从而使更多的突变累积起来。在这种情况下,缺乏ATM的小鼠的生殖细胞中的DNA双链断裂比正常减数分裂期间发生的多10倍以上。他们随后观察了这些断裂是如何被修复的,或者更有可能是如何被错误修复的。
在减数分裂过程期间发生在DNA中的双链断裂通常是通过同源重组来修复的,这个过程发生在受损的DNA找到匹配的基因序列并将这两者结合在一起时。这有助于分割染色体的数量。但在缺少ATM的小鼠中,双链断裂是由一个替代的、不太准确的过程修复的。在这个称为称为非同源末端连接(nonhomologous end joining)的过程中,断裂的DNA末端被简单地缝合在一起。因为当ATM缺失时,会有更多的断裂开始形成,两个断裂的DNA末端可能被缝合在一起。这导致了遗传物质的缺失和重复等错误。
7.Cell:揭示X染色体失活新机制!100个Xist分子足以实现整条X染色体失活
doi:10.1016/j.cell.2021.10.022
在哺乳动物发育的一个奥秘中,早期雌性胚胎中的每个细胞都会关闭其两条X染色体中的一条,只留下一条功能性的X染色体。多年来,这种X染色体失活背后的机制一直很模糊,但是来自美国加州大学洛杉矶分校的研究人员如今在一项新的研究中在理解这一过程方面迈出了重要一步。相关研究结果于2021年11月4日在线发表在Cell期刊上,论文标题为“Xist nucleates local protein gradients to propagate silencing across the X chromosome”。
近三十年来,科学家们已经知道,在胚胎发育早期,X染色体失活需要一种称为Xist的RNA分子。他们还知道,有数百种其他蛋白与Xist相互作用。但在缺乏明确证据的情况下,该领域的大多数人错误地认为,许多Xist拷贝包裹着靶X染色体,或在X染色体上的不同位置不断移动,直接与该染色体上1000多个基因中的每一个相互作用,以诱导它们沉默。
在这项新的研究中,Plath和她的同事们用荧光标记蛋白分子,并使用超分辨率显微镜来观察它们在X染色体上的精确位置。然后,当X染色体在雌性小鼠的胚胎干细胞中发生失活时,该团队能够观察Xist和几十个相互作用的蛋白的运动。他们发现,成对的Xist仅位于X染色体上的50个点,总共有100个Xist分子。
8.Cell:自闭症患者肠道微生物组的差异可能与饮食偏好有关
doi:10.1016/j.cell.2021.10.015
已有研究表明自闭症谱系障碍(autism spectrum disorder, ASD)可能至少部分是由肠道微生物群组成的差异引起的,其依据是观察到某些类型的微生物在自闭症患者中更常见。但是,在一项新的研究中,来自澳大利亚昆士兰大学等研究机构的研究人员这种关联性实际上可能反过来起作用:在自闭症儿童的肠道中发现的微生物物种多样性可能是由于他们与自闭症有关的限制性饮食偏好,而不是他们症状的原因。相关研究结果于2021年11月11日在线发表在Cell期刊上,论文标题为“Autism-related dietary preferences mediate autism-gut microbiome associations”。
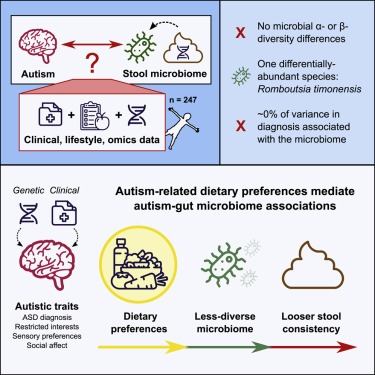
图片来自Cell, 2021, doi:10.1016/j.cell.2021.10.015。
这些作者通过宏基因组测序对这些样本进行了分析,其中宏基因组测序研究的是微生物物种的整个基因组,而不是较短的基因条形码(比如16S分析)。它还提供了基因水平的信息,而不仅仅是物种水平的信息,并提供了比16S分析更准确的微生物组组成的表征,其中16S分析是许多早期研究中使用的一种将肠道微生物组与自闭症联系起来的技术。
根据他们的分析,这些作者发现有限的证据表明自闭症与微生物组的直接关联。然而,他们确实发现自闭症与饮食有高度显著的关联性,确诊的自闭症与较少的饮食多样性和较差的饮食质量有关。此外,自闭症特征程度的心理测量(包括兴趣狭隘、社会交流困难和感觉敏感)以及ASD和冲动/强迫/重复行为的多基因评分也与多样性较少的饮食有关。
9.Cell:震惊!工蚁变成蚁后仅由单个蛋白控制
doi:10.1016/j.cell.2021.10.006
根据社会冲突的结果,蚂蚁物种跳镰猛蚁(Harpegnathos saltator)会做一些不寻常的事情:它们可以从工蚁切换到一种称为gamergate的类似蚁后的地位。如今,在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院的研究人员报告了一个令人惊讶的发现:一种名为Kr-h1(Krüppel homolog 1)的单个蛋白对社会调节激素(socially regulated hormone)做出反应,以协调这种复杂的社会转变。相关研究结果于2021年11月4日在线发表在Cell期刊上,论文标题为“Kr-h1 maintains distinct caste-specific neurotranscriptomes in response to socially regulated hormones”。论文通讯作者为宾夕法尼亚大学佩雷尔曼医学院的Roberto Bonasio和Shelley Berger。论文第一作者为宾夕法尼亚大学佩雷尔曼医学院的Janko Gospocic和Karl Glastad。
在一个蚁群中,工蚁通过寻找食物和打击入侵者来维持蚁群,而蚁后的主要任务是产卵。然而,正是同样的基因指令,产生了这些非常不同的社会角色和行为。通过研究蚂蚁,Bonasio、Berger及其同事们想了解将某些基因“开启”或“关闭”如何影响大脑功能和行为。鉴于成年的跳镰猛蚁可以从工蚁切换到gamergate,它们是这种研究的完美选择。
为了能够研究导致这种转换的潜在分子事件,这些作者开发出一种从蚂蚁身上分离神经元的方法,并在实验室的塑料培养皿中让它们存活。这使得他们能够探索这些神经元如何对环境变化做出反应,包括激素水平的变化。
这些作者进一步确定了两种激素:保幼激素(juvenile hormone)和蜕皮激素(ecdysone),它们以不同的水平存在于工蚁和gamergate的体内,并且在工蚁和gamergate的大脑中产生了不同的基因激活模式。最大的惊喜是这两种激素通过激活单个蛋白Kr-h1来影响这些神经元。
10.Cell:新研究揭示RNA促进细胞核内空间区室的形成
doi:10.1016/j.cell.2021.10.014
在一项新的研究中,来自美国加州理工学院、加州大学洛杉矶分校和南加州大学的研究人员使用了一种强大的新工具,可以窥视细胞的遗传物质(DNA和RNA)的世界。相关研究结果于2021年11月4日在线发表在Cell期刊上,论文标题为“RNA promotes the formation of spatial compartments in the nucleus”。论文通讯作者为加州理工学院生物学教授Mitchell Guttman。

图片来自Cell, 2021, doi:10.1016/j.cell.2021.10.014。
了解遗传物质在空间上是如何组织的,是了解生命基本运作的一个关键部分。细胞核内的功能障碍是许多疾病的一个标志,包括癌症、神经退行性疾病和其他疾病。
这项新的研究是由Guttman实验室开发的一种能够对RNA世界进行详细观察的强大工具促成的,该工具被称为RD-SPRITE(RNA and DNA Split-Pool Recognition of Interactions by Tag Extension)。从本质上讲,RD-SPRITE的工作原理是根据RNA和DNA分子的位置,用微小的独特的条形码对其进行标记,然后分析这些条形码可以告诉你哪些RNA和DNA分子在细胞内的哪个位置。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


