2020年5月HIV研究亮点进展
来源:本站原创 2020-05-31 23:19
2020年5月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴
2020年5月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的5月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.我国科学家揭示HIV-1病毒核心进入宿主细胞核机制
doi:10.1007/s11427-020-1716-x
在一项新的研究中,来自中国科学院和华中科技大学的研究人员通过联合使用细胞分子成像和电子显微镜,发现了HIV-1病毒核心是如何进入宿主细胞核的。相关研究结果于2020年5月14日在线发表在Science China Life Sciences期刊上,论文标题为“HIV-1 viral cores enter the nucleus collectively through the nuclear endocytosis-like pathway”。
人们普遍认为,HIV-1感染细胞的过程包括以下步骤:膜融合、病毒核心释放、逆转录、细胞质中的衣壳解体、病毒基因组进入细胞核、病毒基因组整合,然后利用宿主细胞系统进行自我复制。然而,最近的研究已发现,病毒衣壳也存在于细胞核中,并在整合位点选择和免疫逃逸中发挥着作用。
这些研究人员对HIV-1和宿主细胞的选定成分进行了不同的标记,以便能够动态跟踪病毒与宿主细胞之间的相互作用。他们发现,在进入细胞后,HIV-1病毒颗粒沿微管移动,选择性地聚集在微管组织中心(MTOC),这会导致附近的核膜发生变形、内陷和修复,从而形成包裹住病毒核心的核囊泡。随后,核囊泡内膜破裂,将HIV-1释放到细胞核内。这种现象类似于细胞内吞,因此被命名为“核内吞样途径(nuclear endocytosis-like pathway)”。他们初步研究了涉及这一过程的因素。
2.Science子刊:揭示异基因造血干细胞移植后存在HIV重新感染的脆弱窗口
doi:10.1126/scitranslmed.aay9355
为了治疗不同类型的血癌,一些HIV感染者需要接受异基因造血干细胞移植。在这些移植过程中,这些患者的大部分免疫细胞会被消除。然后,来自健康供者的造血干细胞被用来替换患者受损的骨髓,恢复他们的免疫系统。
在一项新的研究中,来自德国、法国、西班牙、比利时、意大利、英国和荷兰的研究人员收集了16例患者在进行异基因造血干细胞移植前后的临床、病毒学和免疫学数据。他们观察到,尽管存在HIV特异性T细胞的重新激活,但是在异基因造血干细胞移植后,T细胞重建不完全。一段时间的高免疫激活表明存在HIV病毒库重新播种的“脆弱窗口(window of vulnerability)”。这些有价值的数据可能为帮助其他处于类似情况的人提供线索,更一般的是为治愈HIV感染提供线索。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“Vulnerability to reservoir reseeding due to high immune activation after allogeneic hematopoietic stem cell transplantation in individuals with HIV-1”。
论文第一作者Johanna Eberhard博士说,“在异基因造血干细胞移植后的最初几周里,供者细胞和患者细胞仍然共同存在,CD4+ T细胞(辅助性T细胞)被强烈激活。这种激活可能会促进HIV病毒重新激活,并且在不断扩大的CD4+ 供者T细胞中重新播种。”
在与法国巴斯德研究所的研究人员合作中,Eberhard博士发现供者细胞针对HIV蛋白的新的特异性T细胞反应也在这段时间之后产生。这表明供者细胞在增殖过程中接触到了HIV病毒,并且已经学会了对它们作出反应。Eberhard博士说,这证实了“脆弱窗口”的存在,在这段时间内,HIV对供者细胞的感染可能会发生。
3.Nat Med:重磅!新型HIV疫苗策略或能增强并延长灵长类动物机体的免疫力!
doi:10.1038/s41591-020-0858-8
近日,一项刊登在国际杂志Nature Medicine上的研究报告中,来自斯坦福大学医学院等多家机构的科学家们通过研究揭示了一种新型的疫苗策略或能明显增强并维持猴子体内抵御HIV的保护力,此外,本文研究结果对于免疫学家寻找针对诸如冠状病毒等其它疾病的疫苗策略也具有广泛的意义。
研究者Pulendran说道,迄今为止,所有获批的疫苗都是通过诱导抗体来中和病毒的,然而诱导并维持高水平的中和性抗体似乎是一件非常艰巨的任务;我们已经证明,通过刺激免疫系统的细胞臂就能获得抵御HIV的强大保护力,甚至利用较低水平的中和性抗体也是如此。这项最新研究中,研究者采用了一种双重方法旨在刺激血清和细胞免疫力,他们在40周的时间里给予3组共15只恒河猴进行疫苗接种,第一组接受了多次Env的连续接种,Env病毒的外膜蛋白,其能刺激抗体产生,当与佐剂形成化学混合物后就能用于开发增强机体整体免疫系统的疫苗;第二组恒河猴的接种方式与第一组相似,但研究者给其额外注射了三种不同的病毒,其中每一种都经过了改造具有传染性但并不危险,每一种修饰的病毒都含有编码病毒蛋白Gag的基因,这种蛋白质能刺激细胞免疫力的产生;第三组为对照组,研究者仅给予注射了佐剂。
当为期40周的疗程结束时,所有动物都被允许额外休息40周,随后对仅接种Env的动物组进行疫苗强化注射,进行了另外4周休息后,动物们接受了10次SHIV(HIV的猿类版本)的暴露,研究者发现,仅接受佐剂治疗的对照组猴子感染了HIV,而在Env和Env+Gag组中,动物们都经历了抵御病毒感染的显著保护作用;值得注意的是,即使机体缺少较高水平的中和性抗体,一些Env+Gag组动物(但Env动物都没有)仍然没有被感染,研究者认为,中和性抗体升高的血清免疫反应或许是决定疫苗有效性的来源。
此外,Env+Gag组中动物所得到的保护时间明显增加了,在经过20周的休息后,6只Env组猴子和6只Env+Gag组猴子接受了额外的SHIV的暴露,这一次,有4只Env+Gag组猴子(仅有1只Env组猴子)没有被感染。研究者推测,这种改善是由疫苗刺激的称之为组织驻留记忆T细胞的免疫细胞的产生所致,这些细胞会迁移到病毒进入机体的位点并在那里停留一段时间充当哨兵,如果其再次发现病毒的话,这些细胞就会被激活,分泌出信号促进附近其它免疫细胞共同消灭HIV。
4.Science子刊:研究揭示HIV逃脱治疗的机制
doi:10.1126/scitranslmed.aaz0802
根据耶鲁大学的研究人员5月13日在《Science Translational Medicine》杂志上发表的研究,对于艾滋病患者而言,即使成功地进行了抗逆转录病毒治疗,HIV仍可在数十年的免疫系统细胞中处于隐藏休眠状态,并重新出现以威胁患者的生命。如今,耶鲁大学的研究人员已经发现了一种有关这种病毒如何完成这种隐秘技巧的分子机制。
长寿的CD4 T细胞是艾滋病毒的避风港,HIV能够通过将其基因组DNA与T细胞基因组整合在一起,从而逃脱免疫系统的识别。然而,由于病毒此时处于非活性的状态,因此没有留下任何痕迹来标记其位置。
Ho的团队从接受过抗逆转录病毒疗法的HIV患者中提取了细胞。科学家在实验室培养皿中的T细胞中激活了该病毒,并使用荧光探针标记了识别受感染细胞的病毒RNA。然后他们去除了这些罕见的HIV感染细胞,并以高分辨率研究了单个细胞。这种称为HIV SortSeq的方法使研究人员能够追踪宿主RNA与单个细胞内病毒之间的相互作用。
他们发现,HIV实质上劫持了允许T细胞存活的基因。研究人员说,有趣的是,艾滋病毒致力于促进与癌症有关的基因的表达。本质上,HIV从宿主细胞中控制了这些癌症基因的激活控制。研究人员说,尽管这一过程不会在T细胞中引起癌症,但该过程可能有助于这些感染HIV的T细胞增殖。
5.“诱饵”纳米颗粒可以阻断艾滋病毒并防止感染
新闻来源:'Decoy' nanoparticles can block HIV and prevent infection
加州大学圣地亚哥分校的工程师们开发了一种有前途的新"纳米海绵体"方法防止艾滋病病毒在体内增殖:给聚合物纳米粒子涂上辅助T细胞的细胞膜,并将之转化成诱饵拦截病毒粒子和阻止他们结合和进入人体的免疫细胞。
这项由纳米工程教授张良方领导的纳米材料和纳米医学实验室开发的技术,可以应用于许多不同种类的病毒,为有希望对抗难以对付的病毒的新疗法打开了大门。张教授是加州大学圣地亚哥雅各布斯工程学院纳米工程系的教授。
张教授实验室的化学工程师兼项目副科学家Weiwei Gao说:“这里的关键创新是,我们正站在艾滋病这个大问题的另一边。传统的药物开发方法要求我们找出如何阻断病毒中的关键蛋白质或信号通路,使其不能攻击人体。问题是在这些病毒中有这么多的途径,很难找到一个真正关键的途径。”
6.利用新的基因和细胞方法治疗艾滋病的新方法
新闻来源:New approach to curing HIV using novel gene and cell method
位于汉堡的研究人员正试图利用一种新的基因和细胞方法来改善未来对艾滋病患者的治疗。在汉堡生物科技初创公司Provirex的支持下,他们正在开发一种新的治疗方法,使用"基因剪刀"从被感染细胞的基因组中剪去艾滋病病原体HIV的基因,并消灭病毒。这是第一次使得移除病毒成为可能,而不是像以前的治疗方法那样只是将病毒拒之门外。该初创公司将推动Brec1技术的进一步发展。马克斯·普朗克创新公司的一项技术为艾滋病毒基因剪刀的创新奠定了基础。
这一概念是基于Joachim Hauber及其团队在海因里希-佩特研究所(HPI)、莱布尼茨实验病毒学研究所和马克斯·普朗克分子细胞生物学与遗传学研究所以及德累斯顿技术大学进行的研究。他们一起开发并优化了"基因剪刀":重组酶Brec1。该方法目前正在HPI和Hamburg-Eppendorf (UKE) 医疗中心合作进行临床试验。在Nicolaus Kroger的领导下,它将作为干细胞治疗的一部分进行初步评估,涉及到UKE干细胞移植部门的8名艾滋病患者。德国联邦教育和研究部(BMBF)、汉堡参议院和爱尔斯克罗纳-费森尤斯基金会(EKFS)的子公司为此提供了资金和资源。
科学参议员Katharina Fegebank表示:"汉堡创业公司Provirex可以对抗击艾滋病毒和艾滋病做出决定性的贡献。这种新的治疗方式可能使患者细胞第一次永久性、准确地从艾滋病毒中解放出来,这将是治愈艾滋病毒和艾滋病的医学、社会和历史突破。这可能成为抗击艾滋病毒的一个里程碑。我们很高兴现在有机会在汉堡的UKE校区根据我们自己的研究成果开发新的治疗方法。
7.PLoS Pathog:重大进展!鉴定出一种潜在新的潜伏HIV病毒库
doi:10.1371/journal.ppat.1008450
科学家们早就知道,即使接受抗逆转录病毒治疗,一些HIV也会永远存在于感染者体内,隐藏在免疫系统的较小细胞库(亦即HIV病毒库,指的是HIV整合到宿主免疫细胞基因组中而不再活跃地增殖)中。当患者停止治疗后,这种病毒几乎总是从HIV病毒库中迅速反弹,导致致命的症状再次出现。
这些HIV病毒库仍然是治愈HIV/AIDS的主要障碍。但是,目前还没有一种简单的方法可以靶向病毒库细胞以便进行清除。科学家们也无法有效地从患者身上提取出病毒库细胞进行研究,以便最终找到控制它们的方法。原因在于,这些细胞中的HIV病毒是潜伏的。因此,这些细胞的表面并没有携带易被宿主免疫系统发现的病毒蛋白。因此,科学家们一直在寻找其他的方法来精确地找到病毒库细胞。
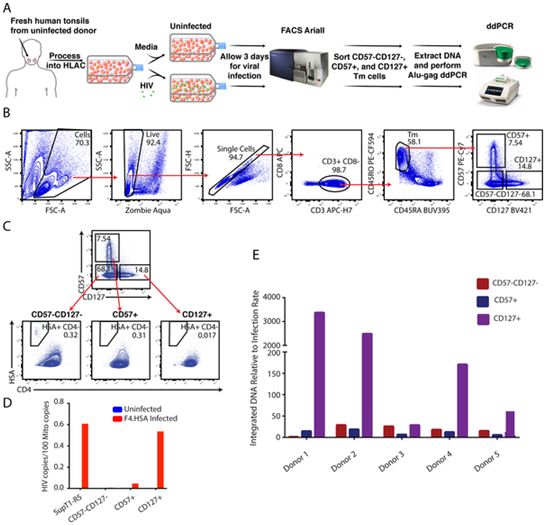
在一项新的研究中,美国格拉德斯通病毒学和免疫学研究所访问学者Nadia Roan博士和她的团队描述了一类优先支持HIV潜伏感染的细胞。这些细胞表达表面蛋白CD127,存在于淋巴结等组织中,并被认为它们携带的HIV病毒库比血液中的更多。相关研究结果近期发表在PLoS Pathogens期刊上,论文标题为“Tissue memory CD4+ T cells expressing IL-7 receptor-alpha (CD127) preferentially support latent HIV-1 infection”。
Roan说,“我们的研究结果表明,组织中的CD127阳性细胞可能是治愈HIV感染的重要靶点。”
8.PNAS:新研究表明苔藓虫素类似物可改善对HIV的根除
doi:10.1073/pnas.1919408117
美国斯坦福大学的化学家Paul Wender和他的同事们正在努力改善对癌症、HIV和阿尔茨海默病的治疗---他们认为,一种海洋无脊椎动物就是实现这一目标的手段。他们把目光投向了这种看似不起眼的生物:总合草苔虫(Bugula neritina),这是因为它与肠道中的细菌合作制造草苔虫素(bryostatin),特别是草苔虫素-1(bryostatin-1),即一类能以至关重要的和可控的方式操纵细胞活动的分子。
在一项新的研究中,来自Wender实验室、加州大学洛杉矶分校Jerome Zack实验室和Matthew Marsden实验室的研究人员与美国国家卫生研究院的Tae-Wook Chun合作,将苔藓虫素修饰为前体药物,而且所产生的前体药物随着时间的推移可以释放出它们的活性形式并展现它们的药效。相关研究结果于2020年5月6日在线发表在PNAS期刊上,论文标题为“Prodrugs of PKC modulators show enhanced HIV latency reversal and an expanded therapeutic window”。
普罗斯左汀(prostratin)、巨大戟酯(ingenol ester)、苔藓虫素及其类似物等蛋白激酶C(PKC)调节剂都是几种处于不同开发阶段的强效的潜伏逆转试剂(latency-reversing agent, LRA),即一类可激活潜伏性感染细胞中的HIV的化合物。虽然LRA很有前景,但与临床使用相关的一个主要挑战是在最大限度地减少副作用的同时,维持有治疗意义的活性药物水平。
在这项新的研究中,在动物模型和来自HIV阳性患者的感染细胞中,他们合成的这些前体药物在体外表现出的活性类似于或优于母体化合物(即苔藓虫素)。选定的前体药物可诱导更高的体内CD69(一种活化生物标志物)表达,并且通过随着时间的推移释放其活性形式,显著提高了耐受性。更一般地说,这些选定的前体药物避免了母体化合物的大剂量毒性,表现出更大的疗效和扩大的耐受性,从而解决了许多临床应用的长期目标。如果在人类身上取得同样的成功,那么HIV患者的治疗频率和药物副作用就会降低。
9.Nat Commun:揭示TRIM5α蛋白阻断HIV感染的分子机制
doi:10.1038/s41467-020-15106-1
恒河猴机体中拥有一种特殊蛋白,当遭遇HIV感染时这种蛋白能帮其机体阻断病毒的入侵;近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自芝加哥大学的科学家们进行了一项创新性研究揭示了恒河猴体内这种名为TRIM5α的免疫蛋白是如何发挥作用的。
研究者Alvin Yu表示,这些特殊的免疫蛋白能将HIV病毒衣壳包裹在一个六角形的网格中同时限制病毒的活性,这种网状结构的缺陷就能使得TRIM5α蛋白拥有包裹任何形状病毒入侵的灵活性。这项研究中,研究人员想通过研究利用计算机模拟的技术揭示该过程背后的物理性原理,但即使使用最大的超级计算机,模拟实际能代表HIV病毒中每一个原子也是比较困难的,因此在模拟中使用一种微妙的方法来挑选关键的部分似乎就是重要的,其也能被安全地像素化,这就是所谓的粗粒化(coarse graining)过程。
研究者Yu表示,TRIM5α蛋白能形成一种二维格子结构,但这种蛋白质如何机体缠绕在三维病毒衣壳上却是一个问题,因此研究人员就需要进行模拟研究来分析这些蛋白质是如何与入侵的病毒相互作用的。研究者所采用的新型模型能够揭示多个关键点,其中一种就是蛋白质能利用一种精细化的跳跃机制来逐渐在衣壳上积累直至其抵达临界点,随着网格结构的生长,蛋白质会以这样的方式挤压在一起从而使得网格结构中开始出现不规则的现象,研究者推测,这种不规则特性非常重要,因为恒河猴体内的TRIM5α蛋白能够不断适应不同形状的HIV“胶囊”,HIV的衣壳会在结构上不断变化,因此这些TRIM蛋白也需要拥有适应不同结构的能力。
10.Nature:揭秘RNA结构多样性在HIV-1 RNA剪接过程中扮演的关键角色
doi:10.1038/s41586-020-2253-5
近日,一项刊登在国际杂志Nature上题为“Determination of RNA structural diversity and its role in HIV-1 RNA splicing”的研究报告中,来自怀特黑德生物医学研究所等机构的科学家们通过研究确定了RNA的结构多样性及其在HIV-1剪接过程中扮演的关键角色。
这项研究中,研究者Phillip J. Tomezsko等人通过研究使用硫酸二甲酯突变谱结合名为DMS-MaPseq的测序技术分析了细胞中HIV-1的RNA的结构,同时他们还开发出了一种名为DREEM的新型算法来解释由相同RNA序列所假设的可变构象结构,DREEM算法即利用期望最大化原则来检测RNA的折叠效果。与此前分析人口平均值的模型相反,本文研究中,研究者揭示了整合HIV-1基因组中RNA结构的异质性区域,除了证实在体外研究中发现的HIV-1 Rev反应元件的替代结构也存在于细胞中外,研究者还发现,关键剪接位点的替代构象或许也会影响转录物亚型的比例。
最后研究者表示,本文研究他们同事测定了RNA的剪接和胞内结构,为长期存在的科学家假设提供了一定的证据,即证实了RNA构象的异质性能够调节剪接位点的使用及病毒基因的表达量,为后期科学家们理解HIV-1感染机体的分子机制提供了新的线索和思路。
11.Science:重大突破!揭示单个鸟苷酸决定着HIV RNA基因组的命运
doi:10.1126/science.aaz7959
人类免疫缺陷病毒(HIV, 也称为艾滋病病毒)感染了100多万美国人和全球4000万人。一项针对HIV病毒结构的新研究揭示出一个有前景的新药物靶标可用于靶向HIV感染。它发现HIV感染的细胞可以通过两种不同的方式读取这种病毒的遗传密码。结果就是被感染的细胞制造出这种病毒RNA的两种不同形式。相关研究结果发表在2020年4月24日的Science期刊上,论文标题为“Structural basis for transcriptional start site control of HIV-1 RNA fate”。
HIV-1 RNA基因组的转录本既可以经剪接后翻译成病毒蛋白,也可以作为子代基因组被包装成新的病毒颗粒。所选择的路径取决于这种转录本是否在5′末端含有一个鸟苷酸(1G)还是两个或三个鸟苷酸(2G或3G)。这项新的研究利用核磁共振光谱学研究发现1G转录本(即5′末端仅含有一个鸟苷酸的HIV-1 RNA基因组转录本)采用二聚体结构,该结构封存了翻译和剪接所需的末端帽,但暴露了与HIV-1 Gag蛋白结合的位点,其中Gag蛋白在病毒组装过程中招募HIV-1 RNA基因组。反之,2G或3G转录本可以接触到这个末端帽,但Gag结合位点被封存。因此,单个鸟苷酸作为一个构象开关,决定了HIV-1转录本的命运。
论文第一作者Joshua Brown说,“这种功能的多样性对于这种病毒在体内复制是必不可少的。这种病毒必须在两种形式的RNA之间保持适当的平衡。几十年来,科学界已经知道HIV RNA存在两种不同的结构形式,只是不知道是什么控制了这种平衡。我们发现单个核苷酸产生巨大的影响,这是理解HIV如何发挥作用的一个观念转变。”(生物谷 Bioon.com)
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的5月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.我国科学家揭示HIV-1病毒核心进入宿主细胞核机制
doi:10.1007/s11427-020-1716-x
在一项新的研究中,来自中国科学院和华中科技大学的研究人员通过联合使用细胞分子成像和电子显微镜,发现了HIV-1病毒核心是如何进入宿主细胞核的。相关研究结果于2020年5月14日在线发表在Science China Life Sciences期刊上,论文标题为“HIV-1 viral cores enter the nucleus collectively through the nuclear endocytosis-like pathway”。

图片来源:NIAID。
人们普遍认为,HIV-1感染细胞的过程包括以下步骤:膜融合、病毒核心释放、逆转录、细胞质中的衣壳解体、病毒基因组进入细胞核、病毒基因组整合,然后利用宿主细胞系统进行自我复制。然而,最近的研究已发现,病毒衣壳也存在于细胞核中,并在整合位点选择和免疫逃逸中发挥着作用。
这些研究人员对HIV-1和宿主细胞的选定成分进行了不同的标记,以便能够动态跟踪病毒与宿主细胞之间的相互作用。他们发现,在进入细胞后,HIV-1病毒颗粒沿微管移动,选择性地聚集在微管组织中心(MTOC),这会导致附近的核膜发生变形、内陷和修复,从而形成包裹住病毒核心的核囊泡。随后,核囊泡内膜破裂,将HIV-1释放到细胞核内。这种现象类似于细胞内吞,因此被命名为“核内吞样途径(nuclear endocytosis-like pathway)”。他们初步研究了涉及这一过程的因素。
2.Science子刊:揭示异基因造血干细胞移植后存在HIV重新感染的脆弱窗口
doi:10.1126/scitranslmed.aay9355
为了治疗不同类型的血癌,一些HIV感染者需要接受异基因造血干细胞移植。在这些移植过程中,这些患者的大部分免疫细胞会被消除。然后,来自健康供者的造血干细胞被用来替换患者受损的骨髓,恢复他们的免疫系统。
在一项新的研究中,来自德国、法国、西班牙、比利时、意大利、英国和荷兰的研究人员收集了16例患者在进行异基因造血干细胞移植前后的临床、病毒学和免疫学数据。他们观察到,尽管存在HIV特异性T细胞的重新激活,但是在异基因造血干细胞移植后,T细胞重建不完全。一段时间的高免疫激活表明存在HIV病毒库重新播种的“脆弱窗口(window of vulnerability)”。这些有价值的数据可能为帮助其他处于类似情况的人提供线索,更一般的是为治愈HIV感染提供线索。相关研究结果近期发表在Science Translational Medicine期刊上,论文标题为“Vulnerability to reservoir reseeding due to high immune activation after allogeneic hematopoietic stem cell transplantation in individuals with HIV-1”。
论文第一作者Johanna Eberhard博士说,“在异基因造血干细胞移植后的最初几周里,供者细胞和患者细胞仍然共同存在,CD4+ T细胞(辅助性T细胞)被强烈激活。这种激活可能会促进HIV病毒重新激活,并且在不断扩大的CD4+ 供者T细胞中重新播种。”
在与法国巴斯德研究所的研究人员合作中,Eberhard博士发现供者细胞针对HIV蛋白的新的特异性T细胞反应也在这段时间之后产生。这表明供者细胞在增殖过程中接触到了HIV病毒,并且已经学会了对它们作出反应。Eberhard博士说,这证实了“脆弱窗口”的存在,在这段时间内,HIV对供者细胞的感染可能会发生。
3.Nat Med:重磅!新型HIV疫苗策略或能增强并延长灵长类动物机体的免疫力!
doi:10.1038/s41591-020-0858-8
近日,一项刊登在国际杂志Nature Medicine上的研究报告中,来自斯坦福大学医学院等多家机构的科学家们通过研究揭示了一种新型的疫苗策略或能明显增强并维持猴子体内抵御HIV的保护力,此外,本文研究结果对于免疫学家寻找针对诸如冠状病毒等其它疾病的疫苗策略也具有广泛的意义。
研究者Pulendran说道,迄今为止,所有获批的疫苗都是通过诱导抗体来中和病毒的,然而诱导并维持高水平的中和性抗体似乎是一件非常艰巨的任务;我们已经证明,通过刺激免疫系统的细胞臂就能获得抵御HIV的强大保护力,甚至利用较低水平的中和性抗体也是如此。这项最新研究中,研究者采用了一种双重方法旨在刺激血清和细胞免疫力,他们在40周的时间里给予3组共15只恒河猴进行疫苗接种,第一组接受了多次Env的连续接种,Env病毒的外膜蛋白,其能刺激抗体产生,当与佐剂形成化学混合物后就能用于开发增强机体整体免疫系统的疫苗;第二组恒河猴的接种方式与第一组相似,但研究者给其额外注射了三种不同的病毒,其中每一种都经过了改造具有传染性但并不危险,每一种修饰的病毒都含有编码病毒蛋白Gag的基因,这种蛋白质能刺激细胞免疫力的产生;第三组为对照组,研究者仅给予注射了佐剂。
当为期40周的疗程结束时,所有动物都被允许额外休息40周,随后对仅接种Env的动物组进行疫苗强化注射,进行了另外4周休息后,动物们接受了10次SHIV(HIV的猿类版本)的暴露,研究者发现,仅接受佐剂治疗的对照组猴子感染了HIV,而在Env和Env+Gag组中,动物们都经历了抵御病毒感染的显著保护作用;值得注意的是,即使机体缺少较高水平的中和性抗体,一些Env+Gag组动物(但Env动物都没有)仍然没有被感染,研究者认为,中和性抗体升高的血清免疫反应或许是决定疫苗有效性的来源。
此外,Env+Gag组中动物所得到的保护时间明显增加了,在经过20周的休息后,6只Env组猴子和6只Env+Gag组猴子接受了额外的SHIV的暴露,这一次,有4只Env+Gag组猴子(仅有1只Env组猴子)没有被感染。研究者推测,这种改善是由疫苗刺激的称之为组织驻留记忆T细胞的免疫细胞的产生所致,这些细胞会迁移到病毒进入机体的位点并在那里停留一段时间充当哨兵,如果其再次发现病毒的话,这些细胞就会被激活,分泌出信号促进附近其它免疫细胞共同消灭HIV。
4.Science子刊:研究揭示HIV逃脱治疗的机制
doi:10.1126/scitranslmed.aaz0802
根据耶鲁大学的研究人员5月13日在《Science Translational Medicine》杂志上发表的研究,对于艾滋病患者而言,即使成功地进行了抗逆转录病毒治疗,HIV仍可在数十年的免疫系统细胞中处于隐藏休眠状态,并重新出现以威胁患者的生命。如今,耶鲁大学的研究人员已经发现了一种有关这种病毒如何完成这种隐秘技巧的分子机制。
长寿的CD4 T细胞是艾滋病毒的避风港,HIV能够通过将其基因组DNA与T细胞基因组整合在一起,从而逃脱免疫系统的识别。然而,由于病毒此时处于非活性的状态,因此没有留下任何痕迹来标记其位置。

图片来源:Www.pixabay.com。
Ho的团队从接受过抗逆转录病毒疗法的HIV患者中提取了细胞。科学家在实验室培养皿中的T细胞中激活了该病毒,并使用荧光探针标记了识别受感染细胞的病毒RNA。然后他们去除了这些罕见的HIV感染细胞,并以高分辨率研究了单个细胞。这种称为HIV SortSeq的方法使研究人员能够追踪宿主RNA与单个细胞内病毒之间的相互作用。
他们发现,HIV实质上劫持了允许T细胞存活的基因。研究人员说,有趣的是,艾滋病毒致力于促进与癌症有关的基因的表达。本质上,HIV从宿主细胞中控制了这些癌症基因的激活控制。研究人员说,尽管这一过程不会在T细胞中引起癌症,但该过程可能有助于这些感染HIV的T细胞增殖。
5.“诱饵”纳米颗粒可以阻断艾滋病毒并防止感染
新闻来源:'Decoy' nanoparticles can block HIV and prevent infection
加州大学圣地亚哥分校的工程师们开发了一种有前途的新"纳米海绵体"方法防止艾滋病病毒在体内增殖:给聚合物纳米粒子涂上辅助T细胞的细胞膜,并将之转化成诱饵拦截病毒粒子和阻止他们结合和进入人体的免疫细胞。
这项由纳米工程教授张良方领导的纳米材料和纳米医学实验室开发的技术,可以应用于许多不同种类的病毒,为有希望对抗难以对付的病毒的新疗法打开了大门。张教授是加州大学圣地亚哥雅各布斯工程学院纳米工程系的教授。
张教授实验室的化学工程师兼项目副科学家Weiwei Gao说:“这里的关键创新是,我们正站在艾滋病这个大问题的另一边。传统的药物开发方法要求我们找出如何阻断病毒中的关键蛋白质或信号通路,使其不能攻击人体。问题是在这些病毒中有这么多的途径,很难找到一个真正关键的途径。”
6.利用新的基因和细胞方法治疗艾滋病的新方法
新闻来源:New approach to curing HIV using novel gene and cell method
位于汉堡的研究人员正试图利用一种新的基因和细胞方法来改善未来对艾滋病患者的治疗。在汉堡生物科技初创公司Provirex的支持下,他们正在开发一种新的治疗方法,使用"基因剪刀"从被感染细胞的基因组中剪去艾滋病病原体HIV的基因,并消灭病毒。这是第一次使得移除病毒成为可能,而不是像以前的治疗方法那样只是将病毒拒之门外。该初创公司将推动Brec1技术的进一步发展。马克斯·普朗克创新公司的一项技术为艾滋病毒基因剪刀的创新奠定了基础。
这一概念是基于Joachim Hauber及其团队在海因里希-佩特研究所(HPI)、莱布尼茨实验病毒学研究所和马克斯·普朗克分子细胞生物学与遗传学研究所以及德累斯顿技术大学进行的研究。他们一起开发并优化了"基因剪刀":重组酶Brec1。该方法目前正在HPI和Hamburg-Eppendorf (UKE) 医疗中心合作进行临床试验。在Nicolaus Kroger的领导下,它将作为干细胞治疗的一部分进行初步评估,涉及到UKE干细胞移植部门的8名艾滋病患者。德国联邦教育和研究部(BMBF)、汉堡参议院和爱尔斯克罗纳-费森尤斯基金会(EKFS)的子公司为此提供了资金和资源。
科学参议员Katharina Fegebank表示:"汉堡创业公司Provirex可以对抗击艾滋病毒和艾滋病做出决定性的贡献。这种新的治疗方式可能使患者细胞第一次永久性、准确地从艾滋病毒中解放出来,这将是治愈艾滋病毒和艾滋病的医学、社会和历史突破。这可能成为抗击艾滋病毒的一个里程碑。我们很高兴现在有机会在汉堡的UKE校区根据我们自己的研究成果开发新的治疗方法。
7.PLoS Pathog:重大进展!鉴定出一种潜在新的潜伏HIV病毒库
doi:10.1371/journal.ppat.1008450
科学家们早就知道,即使接受抗逆转录病毒治疗,一些HIV也会永远存在于感染者体内,隐藏在免疫系统的较小细胞库(亦即HIV病毒库,指的是HIV整合到宿主免疫细胞基因组中而不再活跃地增殖)中。当患者停止治疗后,这种病毒几乎总是从HIV病毒库中迅速反弹,导致致命的症状再次出现。
这些HIV病毒库仍然是治愈HIV/AIDS的主要障碍。但是,目前还没有一种简单的方法可以靶向病毒库细胞以便进行清除。科学家们也无法有效地从患者身上提取出病毒库细胞进行研究,以便最终找到控制它们的方法。原因在于,这些细胞中的HIV病毒是潜伏的。因此,这些细胞的表面并没有携带易被宿主免疫系统发现的病毒蛋白。因此,科学家们一直在寻找其他的方法来精确地找到病毒库细胞。

图片来自PLoS Pathogens, 2020, doi:10.1371/journal.ppat.1008450。
在一项新的研究中,美国格拉德斯通病毒学和免疫学研究所访问学者Nadia Roan博士和她的团队描述了一类优先支持HIV潜伏感染的细胞。这些细胞表达表面蛋白CD127,存在于淋巴结等组织中,并被认为它们携带的HIV病毒库比血液中的更多。相关研究结果近期发表在PLoS Pathogens期刊上,论文标题为“Tissue memory CD4+ T cells expressing IL-7 receptor-alpha (CD127) preferentially support latent HIV-1 infection”。
Roan说,“我们的研究结果表明,组织中的CD127阳性细胞可能是治愈HIV感染的重要靶点。”
8.PNAS:新研究表明苔藓虫素类似物可改善对HIV的根除
doi:10.1073/pnas.1919408117
美国斯坦福大学的化学家Paul Wender和他的同事们正在努力改善对癌症、HIV和阿尔茨海默病的治疗---他们认为,一种海洋无脊椎动物就是实现这一目标的手段。他们把目光投向了这种看似不起眼的生物:总合草苔虫(Bugula neritina),这是因为它与肠道中的细菌合作制造草苔虫素(bryostatin),特别是草苔虫素-1(bryostatin-1),即一类能以至关重要的和可控的方式操纵细胞活动的分子。
在一项新的研究中,来自Wender实验室、加州大学洛杉矶分校Jerome Zack实验室和Matthew Marsden实验室的研究人员与美国国家卫生研究院的Tae-Wook Chun合作,将苔藓虫素修饰为前体药物,而且所产生的前体药物随着时间的推移可以释放出它们的活性形式并展现它们的药效。相关研究结果于2020年5月6日在线发表在PNAS期刊上,论文标题为“Prodrugs of PKC modulators show enhanced HIV latency reversal and an expanded therapeutic window”。
普罗斯左汀(prostratin)、巨大戟酯(ingenol ester)、苔藓虫素及其类似物等蛋白激酶C(PKC)调节剂都是几种处于不同开发阶段的强效的潜伏逆转试剂(latency-reversing agent, LRA),即一类可激活潜伏性感染细胞中的HIV的化合物。虽然LRA很有前景,但与临床使用相关的一个主要挑战是在最大限度地减少副作用的同时,维持有治疗意义的活性药物水平。
在这项新的研究中,在动物模型和来自HIV阳性患者的感染细胞中,他们合成的这些前体药物在体外表现出的活性类似于或优于母体化合物(即苔藓虫素)。选定的前体药物可诱导更高的体内CD69(一种活化生物标志物)表达,并且通过随着时间的推移释放其活性形式,显著提高了耐受性。更一般地说,这些选定的前体药物避免了母体化合物的大剂量毒性,表现出更大的疗效和扩大的耐受性,从而解决了许多临床应用的长期目标。如果在人类身上取得同样的成功,那么HIV患者的治疗频率和药物副作用就会降低。
9.Nat Commun:揭示TRIM5α蛋白阻断HIV感染的分子机制
doi:10.1038/s41467-020-15106-1
恒河猴机体中拥有一种特殊蛋白,当遭遇HIV感染时这种蛋白能帮其机体阻断病毒的入侵;近日,一项刊登在国际杂志Nature Communications上的研究报告中,来自芝加哥大学的科学家们进行了一项创新性研究揭示了恒河猴体内这种名为TRIM5α的免疫蛋白是如何发挥作用的。
研究者Alvin Yu表示,这些特殊的免疫蛋白能将HIV病毒衣壳包裹在一个六角形的网格中同时限制病毒的活性,这种网状结构的缺陷就能使得TRIM5α蛋白拥有包裹任何形状病毒入侵的灵活性。这项研究中,研究人员想通过研究利用计算机模拟的技术揭示该过程背后的物理性原理,但即使使用最大的超级计算机,模拟实际能代表HIV病毒中每一个原子也是比较困难的,因此在模拟中使用一种微妙的方法来挑选关键的部分似乎就是重要的,其也能被安全地像素化,这就是所谓的粗粒化(coarse graining)过程。
研究者Yu表示,TRIM5α蛋白能形成一种二维格子结构,但这种蛋白质如何机体缠绕在三维病毒衣壳上却是一个问题,因此研究人员就需要进行模拟研究来分析这些蛋白质是如何与入侵的病毒相互作用的。研究者所采用的新型模型能够揭示多个关键点,其中一种就是蛋白质能利用一种精细化的跳跃机制来逐渐在衣壳上积累直至其抵达临界点,随着网格结构的生长,蛋白质会以这样的方式挤压在一起从而使得网格结构中开始出现不规则的现象,研究者推测,这种不规则特性非常重要,因为恒河猴体内的TRIM5α蛋白能够不断适应不同形状的HIV“胶囊”,HIV的衣壳会在结构上不断变化,因此这些TRIM蛋白也需要拥有适应不同结构的能力。
10.Nature:揭秘RNA结构多样性在HIV-1 RNA剪接过程中扮演的关键角色
doi:10.1038/s41586-020-2253-5
近日,一项刊登在国际杂志Nature上题为“Determination of RNA structural diversity and its role in HIV-1 RNA splicing”的研究报告中,来自怀特黑德生物医学研究所等机构的科学家们通过研究确定了RNA的结构多样性及其在HIV-1剪接过程中扮演的关键角色。
这项研究中,研究者Phillip J. Tomezsko等人通过研究使用硫酸二甲酯突变谱结合名为DMS-MaPseq的测序技术分析了细胞中HIV-1的RNA的结构,同时他们还开发出了一种名为DREEM的新型算法来解释由相同RNA序列所假设的可变构象结构,DREEM算法即利用期望最大化原则来检测RNA的折叠效果。与此前分析人口平均值的模型相反,本文研究中,研究者揭示了整合HIV-1基因组中RNA结构的异质性区域,除了证实在体外研究中发现的HIV-1 Rev反应元件的替代结构也存在于细胞中外,研究者还发现,关键剪接位点的替代构象或许也会影响转录物亚型的比例。
最后研究者表示,本文研究他们同事测定了RNA的剪接和胞内结构,为长期存在的科学家假设提供了一定的证据,即证实了RNA构象的异质性能够调节剪接位点的使用及病毒基因的表达量,为后期科学家们理解HIV-1感染机体的分子机制提供了新的线索和思路。
11.Science:重大突破!揭示单个鸟苷酸决定着HIV RNA基因组的命运
doi:10.1126/science.aaz7959
人类免疫缺陷病毒(HIV, 也称为艾滋病病毒)感染了100多万美国人和全球4000万人。一项针对HIV病毒结构的新研究揭示出一个有前景的新药物靶标可用于靶向HIV感染。它发现HIV感染的细胞可以通过两种不同的方式读取这种病毒的遗传密码。结果就是被感染的细胞制造出这种病毒RNA的两种不同形式。相关研究结果发表在2020年4月24日的Science期刊上,论文标题为“Structural basis for transcriptional start site control of HIV-1 RNA fate”。

图片来自CC0 Public Domain。
HIV-1 RNA基因组的转录本既可以经剪接后翻译成病毒蛋白,也可以作为子代基因组被包装成新的病毒颗粒。所选择的路径取决于这种转录本是否在5′末端含有一个鸟苷酸(1G)还是两个或三个鸟苷酸(2G或3G)。这项新的研究利用核磁共振光谱学研究发现1G转录本(即5′末端仅含有一个鸟苷酸的HIV-1 RNA基因组转录本)采用二聚体结构,该结构封存了翻译和剪接所需的末端帽,但暴露了与HIV-1 Gag蛋白结合的位点,其中Gag蛋白在病毒组装过程中招募HIV-1 RNA基因组。反之,2G或3G转录本可以接触到这个末端帽,但Gag结合位点被封存。因此,单个鸟苷酸作为一个构象开关,决定了HIV-1转录本的命运。
论文第一作者Joshua Brown说,“这种功能的多样性对于这种病毒在体内复制是必不可少的。这种病毒必须在两种形式的RNA之间保持适当的平衡。几十年来,科学界已经知道HIV RNA存在两种不同的结构形式,只是不知道是什么控制了这种平衡。我们发现单个核苷酸产生巨大的影响,这是理解HIV如何发挥作用的一个观念转变。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


