2021年5月Science期刊不得不看的亮点研究
来源:本站原创 2021-05-31 23:48
1.Science:新研究揭示较大环境中哺乳动物大脑的空间编码doi:10.1126/science.abg4020; doi:10.1126/science.abi9663大脑经常被比作一台电脑,它的硬件由组装在复杂回路中的神经元组成;它的软件是管理神经元行为的大量编码。但有时,即使大脑的硬件似乎不足以完成任务,它也会表现得异常出色。例如,尽管大脑的空间感
1.Science:新研究揭示较大环境中哺乳动物大脑的空间编码
doi:10.1126/science.abg4020; doi:10.1126/science.abi9663
大脑经常被比作一台电脑,它的硬件由组装在复杂回路中的神经元组成;它的软件是管理神经元行为的大量编码。但有时,即使大脑的硬件似乎不足以完成任务,它也会表现得异常出色。例如,尽管大脑的空间感知回路似乎适合代表更小的区域,但是人类和其他哺乳动物如何设法在大规模环境中导航的,这一直是个谜。
在一项新的研究中,来自以色列魏兹曼科学研究所的研究人员通过跳出实验框框思考,解决了这个难题。通过将一种不寻常的研究模型---果蝠(fruit bat)---与一个不寻常的环境---200米长的蝙蝠隧道---相结合,他们成功地揭示了一种新的感知空间的神经编码。相关研究结果发表在2021年5月28日的Science期刊上,论文标题为“Multiscale representation of very large environments in the hippocampus of flying bats”。
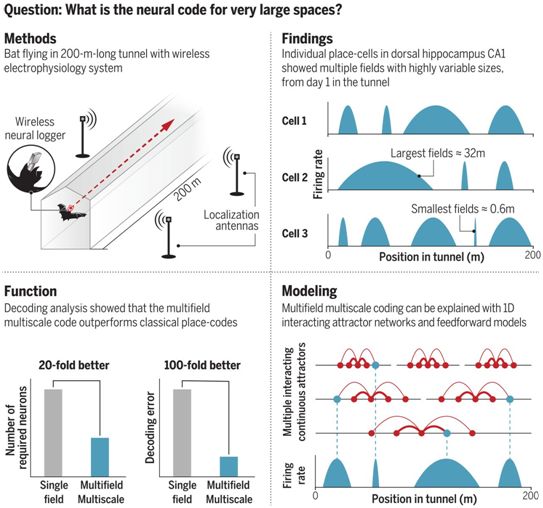
较大环境下的多尺度海马体空间编码,图片来自Science, 2021, doi:10.1126/science.abg4020。
为了验证这一假设,这些作者在魏兹曼科学研究所建造200米长的蝙蝠隧道--一个细长的、不透明的温室,这是世界上第一个建造这样的地方。他们表示,尽管他们的隧道不是确切的20公里长,但200米仍然大大超过了许多科学家们迄今为止所能研究的范围。此外,他们开发出一种微型神经记录器装置(miniature neural logger device),该装置安装在蝙蝠的头上,用于记录它们海马体中神经元的飞行活动,其中海马体是负责记忆存储的大脑区域,包括空间记忆。这些作者还安装了一系列天线,提供比GPS更精确的定位能力,而GPS是追踪在隧道内飞行的蝙蝠所必需的。基于此,他们如今能够在一种更好地模拟其自然行为的环境中研究他们的飞翔对象。
2.Science:重大进展!一种新的细胞核分类系统出炉!发现在两种细胞核类型之间来回切换的方法
doi:10.1126/science.abe2218
150年前,俄国科学家Dmitri Mendeleev创造了化学元素周期表,这是一个根据原子核的特性对原子进行分类的系统。如今,在一项新的研究中,一个研究生命之树的生物学家团队公布了一个新的细胞核分类系统,并发现了一种将一种类型的细胞核转化为另一种类型的细胞核的方法。相关研究结果发表在2021年5月28日的Science期刊上,论文标题为“3D genomics across the tree of life reveals condensin II as a determinant of architecture type”。
这项研究是几次单独努力的结果。其中的一个努力聚焦于DNA动物园(DNA Zoo),这是一个由十几个机构组成的国际联盟,包括贝勒医学院、美国国家科学基金会支持的莱斯大学理论生物物理中心(CTBP)、西澳大学和海洋世界(SeaWorld)。DNA动物园团队的科学家们一直在一起工作,对可以有几米长的染色体如何折叠以适应整个生命树上不同物种的细胞核进行分类。无论是观察蠕虫、海胆、海鞘还是珊瑚,他们一直看到相同的折叠模式出现。最终,他们意识到他们看到了两个整体的细胞核结构:在一些物种中,染色体的组装方式就像印刷报纸的页面,外缘在一边,折叠的中间在另一边;在其他物种中,每条染色体都被揉成了一个小球。
他们遇到了难题。这些数据提示着,在进化过程中,物种可以在一种细胞核类型和另一种细胞核类型之间来回切换。他们想知道:这种控制机制是什么?是否有可能在实验室里将一种类型的细胞核变为另一种类型的细胞核?
与此同时,荷兰的一个独立团队(下称荷兰团队)也发现了一些意想不到的东西。该团队当时正在做一种叫做凝缩蛋白II(condensin II)的蛋白质的实验,他们知道它在细胞如何分裂中起作用,但是他们观察到最奇怪的事情:当在人类细胞中让该蛋白发生突变时,染色体会完全重新排列,这真是令人费解。
这两个团队在奥地利山区的一次会议上相遇,并进行相互交流。他们很快意识到,他们找到了一种将人类细胞从一种细胞核类型转换为另一种细胞核类型的方法。
3.Science:利用源自宿主细胞的非典型crRNA可实现Cas9的多重RNA检测
doi:10.1126/science.abe7106; doi:10.1126/science.abi9335
CRISPR-Cas免疫系统通过CRISPR RNA(crRNA)的引导降解外来遗传物质。crRNA作为间隔重复序列单元被编码在这种系统的CRISPR阵列中。每个crRNA通常由对CRISPR阵列进行转录而来的前体进行加工而成,然后与这种系统的Cas效应核酸酶(比如Cas9)合作,直接裂解靶核酸。在作为Cas9核酸酶和许多CRISPR技术的来源的II型系统中,crRNA加工和随后Cas9的DNA靶向需要反式激活crRNA(trans-activating crRNA, tracrRNA)。tracrRNA与转录的CRISPR阵列中每个crRNA的“重复序列”部分杂交。然后,宿主的RNase III裂解形成的RNA茎,产生加工后的crRNA:tracrRNA双链,以供Cas9使用。目前还不清楚的是crRNA是否局限于CRISPR-Cas位点,还是可以从基因组的其他地方获得。
在一项新的研究中,来自德国维尔茨堡大学等研究机构的研究人员发现crRNA可以来自CRISPR-Cas位点以外的宿主RNA,这促进他们开一种新的基于Cas9的诊断平台,允许在一次测试中可扩展地检测多种生物标志物。相关研究结果于2021年4月27日在线发表在Science期刊上,论文标题为“Noncanonical crRNAs derived from host transcripts enable multiplexable RNA detection by Cas9”。
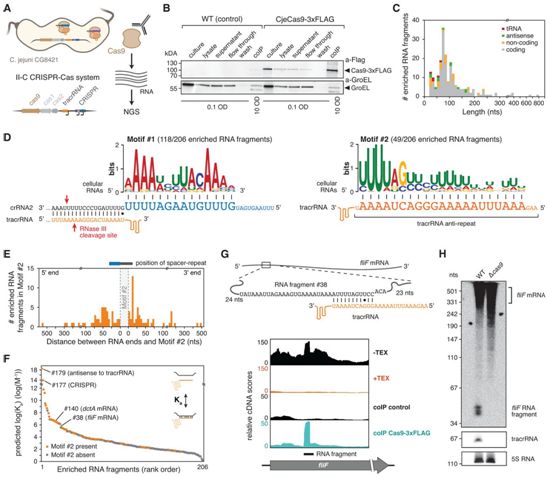
空肠弯曲菌中Cas9结合的细胞RNA片段类似于crRNA。图片来自Science, 2021, doi:10.1126/science.abe7106。
这些富集的RNA片段的Cas9结合、预测的tracrRNA配对和长度分布表明,tracrRNA与内源性RNA配对,形成了非典型的crRNA(ncrRNA)。因此,预计ncrRNA可以将Cas9引导到两侧为前间区序列邻近基序(protospacer-adjacent motif, PAM)的互补DNA靶标上,类似于典型的crRNA。由于产生检测到的ncrRNA的所有基因都没有正确放置的PAM,因此预计ncrRNA不能引导Cas9裂解它们的起始基因组位点。
这些作者进一步证实,重编程的tracrRNA(reprogrammed tracrRNA, Rptr)可以将感兴趣的RNA的存在与Cas9的序列特异性DNA靶向联系起来。这种能力可以使Cas9在体内的应用(比如多重转录记录或转录依赖的编辑)成为可能。最直接的应用涉及通过LEOPARD(Leveraging Engineered tracrRNAs and On-target DNAs for PArallel RNA Detection, 利用工程tracrRNA和在靶DNA进行平行RNA检测)在体外进行多重RNA检测。
目前的CRISPR诊断主要依靠Cas12a或Cas13寻找样品中的双链DNA或RNA靶标,在此过程中,靶标识别引起非特异性的单链DNA或RNA裂解荧光报告分子。非特异性荧光读取实际上将一次测试限制为针对一个靶序列。相反,重编程tracrRNA将识别到的RNA转化为ncrRNA,这将引导Cas9靶向匹配的DNA。Cas9结合或裂解匹配的DNA序列将表明样品中存在识别到的RNA。由于每个DNA靶标的序列都是独一无二的,大量的靶序列可以在一次测试中被平行监测。这些作者将由此产生的诊断平台称为LEOPARD。
4.Science:通过脑-机接口唤起触觉,让一名瘫痪17年的人改善对机械臂的控制
doi:10.1126/science.abd0380; doi:10.1126/science.abi7262
大多数身体健全的人认为他们执行简单日常任务的能力是理所当然的---当他们伸手去拿一杯热咖啡时,他们可以感觉到它的重量和温度,并相应地调整他们的握力,以便没有液体溢出。对手臂和手有充分感觉和运动控制的人,在触摸或抓住物体的瞬间就能感觉到他们已经接触到物体,使他们能够自信地开始移动或提起物体。但是,当一个人操作假肢时,这些任务就会变得更加困难,更不用说用意念控制的假肢了。
在一项新的研究中,来自美国匹兹堡大学等研究机构的研究人员描述了如何通过增加大脑刺激来唤起触觉,从而使操作者更容易操纵大脑控制的机械臂。在实验中,用人工触觉补充视觉,将抓取和转移物体的时间减少了一半,从中位时间20.9秒减少到10.2秒。相关研究结果发表在2021年5月21日的Science期刊上,论文标题为“A brain-computer interface that evokes tactile sensations improves robotic arm control”。
研究参与者Nathan Copeland是世界上第一个不仅在他的大脑运动皮层,而且也在他的躯体感觉皮层(somatosensory cortex)中植入微小电极阵列的人,其中躯体感觉皮层是大脑中处理身体感觉信息的区域。电极阵列使他不仅能用意念控制机械臂,还能接收触觉反馈,这与人体的脊髓完好无损时的神经回路运作方式相似。

双向BCI系统概述,图片来自Science, 2021, doi:10.1126/science.abd0380。
这篇论文是在早期研究---首次描述了使用微小的电脉冲刺激大脑的感觉区域以唤起人们的手的不同区域的感觉,即使他们因脊髓损伤而失去肢体感觉---的基础上迈出的重要一步。在这项新的研究中,这些作者将从大脑读取信息来控制机械臂的运动与将信息写回去提供感觉反馈结合起来。
5.Science:揭示SLFN2基因保护T细胞免受氧化应激机制
doi:10.1126/science.aba4220; doi:10.1126/science.abi7265
被同源抗原(cognate antigen)和共刺激(costimulation)激活的幼稚T细胞(naïve T cell)增殖并分化为效应T细胞。这种从静止状态到增殖状态的转变需要细胞代谢的深刻变化,特别是糖酵解、谷氨酰胺分解(glutaminolysis)和线粒体代谢的增加,以产生高水平的5'-三磷酸腺苷(ATP)。T细胞依赖于翻译爆发(translational burst)来产生支持代谢增加的代谢酶,并产生克隆T细胞后代的蛋白成分及其细胞因子。矛盾的是,为生长和增殖提供能量的代谢过程也产生活性氧(ROS)。ROS能够诱发氧化应激,从而导致翻译抑制。另一方面,ROS在T细胞受体(TCR)信号转导中发挥第二信使的作用,对增殖和效应功能的产生至关重要。这表明为了保持ROS的信号转导活性,除了简单地降低T细胞中的ROS水平外,还可能在多个层面上出现抵抗氧化应激的保护机制。
通过对影响免疫力的突变进行小鼠正向遗传筛选,来自美国德克萨斯大学西南医学中心的研究人员以前发现了Schlafen 2(Slfn2)基因的隐性突变,该隐性突变导致对细菌和病毒感染的易感性升高,并导致T细胞数量减少,无法对感染和各种增殖性刺激作出反应。在一项新的研究中,这些作者旨在通过产生具有T细胞特异性的Slfn2缺失的小鼠来研究SLFN2在T细胞中的分子功能。相关研究结果发表在2021年5月14日的Science期刊上,论文标题为“SLFN2 protection of tRNAs from stress-induced cleavage is essential for T cell–mediated immunity”。
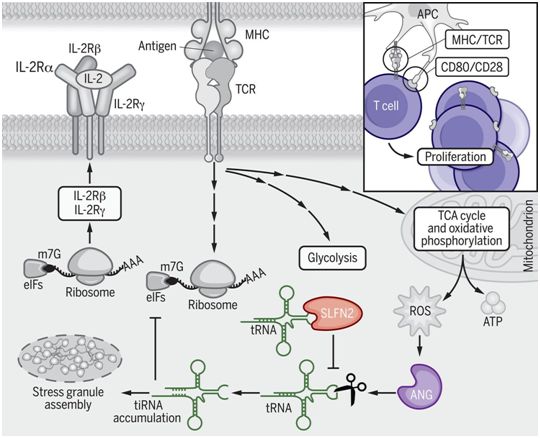
SLFN2保护tRNA免受氧化应激诱导的切割,从而阻止tRNA片段(tiRNA)的翻译抑制,图片来自Science, 2021, doi:10.1126/science.aba4220。
细胞氧化应激反应包括由血管生成素(Angiogenin, ANG)产生的转移RNA (tRNA)片段对翻译的抑制,其中ANG是一种应激诱导的tRNA导向核糖核酸酶(RNase)。ANG在tRNA的反密码子环内进行切割,产生长30~40个核苷酸的tRNA片段(tiRNA)。为了应对TCR激活,SLFN2缺失的T细胞积累了tiRNA,这种tiRNA积累可以通过抗氧化剂处理或者ANG敲降或抑制来减少。此外, SLFN缺失的T细胞在激活后的全局翻译速率可以通过抗氧化剂处理或ANG敲降而得到拯救。SLFN2直接与tRNA结合,但对它们没有核酸溶解活性(nucleolytic activity),这与其他SLFN蛋白不同。SLFN2与tRNA的结合阻止了ANG对tRNA的切割,从而避免了tiRNA的积累和tiRNA介导的翻译抑制。
6.Science:揭示SNRPA1介导的选择性剪接途径促进癌症转移
doi:10.1126/science.abc7531
选择性剪接(alternative splicing)是一种转录后调控机制,对转录组和蛋白质组的多样性至关重要。通过增加蛋白水平的复杂性,选择性剪接可以引起细胞的功能变化。众所周知,RNA结构元件在转录后调控过程(包括选择性剪接)中起着关键作用。因此,由RNA二级结构编码的调节信息对选择性剪接决定的作用是特别令人感兴趣的。选择性剪接模式的变化已被证明可以控制癌症的进展和转移,因此这一过程的驱动因素具有临床意义。
选择性剪接模式的病理变化被认为是癌症的一个标志,然而控制这一过程的基本调控程序在很大程度上仍然是未知的。更好地理解这些调控程序的一个主要障碍是,通常用于发现顺式调控元件的生物信息学策略未能揭示RNA二级结构对调控信息的贡献。为了解决这个问题,来自美国、加拿大和英国的研究人员之前开发出计算框架TEISER(Tool for Eliciting Informative Structural Elements in RNA),它使用RNA结构和序列信息来识别提供关于转录组变化的信息的顺式调控元件。在一项新的研究中,这些研究人员介绍了pyTEISER(pythonic TEISER),它结合了实验推导的和额外的计算预测的RNA结构信息,以研究支配更广泛的RNA相关过程(包括剪接和RNA加工)的RNA序列和结构代码,以及稳态基因表达。相关研究结果发表在2021年5月14日的Science期刊上,论文标题为“A prometastatic splicing program regulated by SNRPA1 interactions with structured RNA elements”。
通过将pyTEISER应用于来自细胞系和患者来源的乳腺癌转移异种移植模型的数据,以及来自原发性乳腺肿瘤和转移瘤的匹配临床样本的测量数据,这些作者发现了并在功能上表征了一种以前未知的作为剪接增强子(splicing enhancer)起作用的RNA结构元件。他们发现这种结构元件在高度转移的乳腺癌中驱动异常的选择性剪接,而且RNA结合蛋白SNRPA1通过与这种结构元件的直接相互作用来介导这种选择性剪接途径,为此他们将这种结构元件命名为SNRPA1相关的结构剪接增强子(SNRPA1-associated structural splicing enhancer, S3E)。这种结构元件位于盒式外显子(cassette exon)附近,SNRPA1表达较高的细胞包含更多的盒式外显子。虽然SNRPA1是U2 snRNP的核心成分,但是这些作者提供的证据表明,SNRPA1调节含S3E外显子的剪接,而且这种调节与它的剪接体功能无关。
这些作者确定了SNRPA1-S3E在体外和体内相互作用的功能序列和结构要求,并证实这种以前未知的SNRPA1-S3E调控途径在高度转移的乳腺癌细胞中是上调的。他们发现,通过影响乳腺癌细胞的侵袭性,调节SNRPA1的表达对乳腺癌细胞的转移能力有重大影响。相反,SNRPA1的表达水平与细胞增殖或原发肿瘤生长的变化无关。重要的是,他们确定PLEC是SNRPA1介导的选择性剪接的靶标,并发现这种SNRPA1调节的发生选择性剪接的plectin异形体在转移性肿瘤中也是上调的。他们还发现,使用反义吗啉基寡核苷酸校正PLEC剪接可以通过下调乳腺癌细胞的浸润性来降低它们的转移能力。
7.Science:揭示驱动和控制好奇心的脑回路
doi:10.1126/science.abe9681; doi:10.1126/science.abi7270
动机驱动(motivational drive)是一种内部状态,即使在与外部刺激的相似互动中也会有所不同。作为寻求新奇事物和调查周围环境的动机驱动,好奇心对于生存来说,与饥饿一样是必不可少的和内在的。好奇心、饥饿和食欲攻击驱动着三种不同的目标导向行为---寻求新奇、吃食物和狩猎---但这些行为在动物中是由类似的行动组成的。这种行为的相似性使得研究新奇寻求并将它与无关节动物(nonarticulating animal)的进食和狩猎区分开来成为一项挑战。这种基本的生存动力、好奇心和新奇寻求行为背后的大脑机制仍不清楚。
尽管有发达的技术来研究小鼠的大脑回路,但在动机行为领域仍有许多有争议的不同结果。这使得诸如未定区(zona incerta, ZI)之类的动机性脑区的功能仍然不确定。没有透明的、非强化的、易于复制的范式是造成这种不确定性的主要原因之一。为此,在一项新的研究中,来自荷兰神经科学研究所的研究人员选择了一个简单的解决方案来开展研究:让小鼠自由选择它想要的东西--双向自由获取选择(free-access double-choice, FADC)。通过使用光遗传学、化学遗传学、钙纤维光度计、多通道记录电生理学和多色mRNA原位杂交对小鼠进行一系列物体FADC和社会互动测试的实验,这些作者发现了一种针对好奇心和新奇寻求行为的细胞类型特异性的皮层-皮层下脑回路(cell type–specific cortico-subcortical brain circuit)的好奇心和寻求新奇的行为。相关研究结果发表在2021年5月14日的Science期刊上,论文标题为“A cell type–specific cortico-subcortical brain circuit for investigatory and novelty-seeking behavior”。
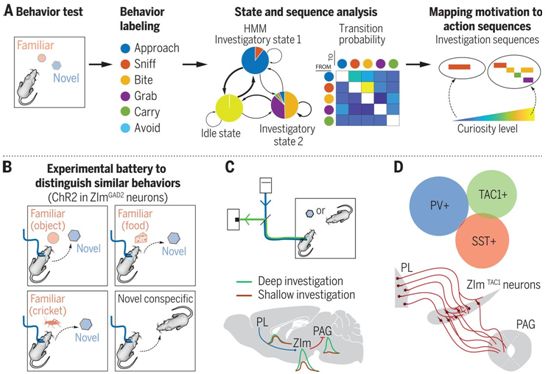
驱动和控制好奇心的大脑机制,图片来自Science, 2021, doi:10.1126/science.abe9681。
他们通过这些实验揭示了基于新奇寻求的动机水平的不同行动序列。此外,这些作者发现了一个新的大脑回路,该回路涉及好奇心和新奇寻求行为,并通过ZIm的TAC1+抑制性神经元将PL的兴奋性神经元连接到侧中脑导水管周围灰质(lateral periaqueductal gray, lPAG)。
8. Science:揭示人类纹状体发育的单细胞图谱
doi:10.1126/science.abf5759
纹状体(striatum)调节着人类社会行为的不同特征,也是在许多神经系统疾病中受到影响的区域。在一项新的研究中,来自意大利、英国和美国的研究人员构建出人类早期胎儿发育过程中该区域的综合单细胞图谱,同时考虑了蛋白编码转录物和长基因间非编码RNA(long intergenic noncoding RNA, lincRNA)。相关研究结果发表在2021年5月7日的Science期刊上,论文标题为“The coding and long noncoding single-cell atlas of the developing human fetal striatum”。
对人类纹状体发育的分子机制的理解受到了限制,这是因为相关的胎儿组织很少,而且在大多数基因鉴定研究中只使用了有限的一组蛋白编码基因。这些作者构建出外侧节隆起(lateral ganglionic eminence, LGE)---纹状体的前体结构---的细胞特异性分子图谱。他们的第一个目标是利用批量RNA测序(bulk RNA sequencing)确定这个区域的新鉴定的lincRNA目录。这个目录应该有助于澄清人类发育的具体特征,因为lincRNA表现出加速进化,具有高度的细胞特异性,并且是大脑发育所需要的。他们的第二个目标是了解中棘神经元(medium spiny neuron, MSN)---纹状体的主要细胞类型---是如何分化和多样化的,以及哪些基因是命运决定的主要调节因子。MSN分化为D1和D2类型,因其表达人类多巴胺受体的两个变体之一(D1和D2)而得名。他们使用单细胞RNA测序来推断MSN的发育状况,并确定和验证它们的命运标志物。
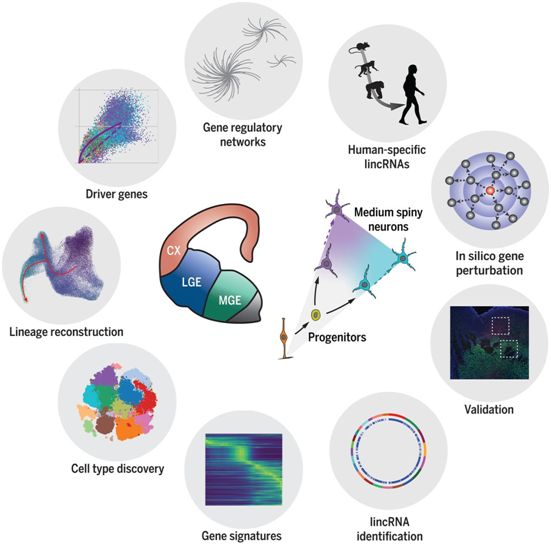
纹状体发育的分子蓝图,图片来自Science, 2021, doi:10.1126/science.abf5759。
9.Science:新研究表明所有年龄组的SARS-CoV-2感染者的传染性水平大致相同
doi:10.1126/science.abi5273
起初是对常规实验室数据的初步分析,后来发展成为有史以来对SARS-CoV-2患者的病毒载量水平的最大规模研究。在一项新的研究中,来自德国柏林夏洛特医科大学的研究人员分析了超过25000名COVID-19患者的PCR样本。他们确定了每个样本的病毒载量,并利用他们的结果来估计传染性水平。这就为不同年龄组和不同疾病严重程度下的疾病传染性提供了一个清晰的概念。它还提供了对SARS-CoV-2病毒变体B.1.1.7的新见解。相关研究结果于2021年5月25日在线发表在Science期刊上,论文标题为“Estimating infectiousness throughout SARS-CoV-2 infection course”。
为了更好地了解和估计特定群体的传染性,这些作者分析了25000多例COVID-19病例的PCR样本,以确定这些样本的病毒载量。每个样本的病毒载量---样本中包含的SARS-CoV-2基因组的总拷贝数---提供了对患者咽喉中存在的病毒数量的粗略估计,因此是估计个人传染性的一个有用指标。为了进一步改进他们的估计,他们还应用了关于在细胞培养物中成功分离SARS-CoV-2(分离表明存在传染性病毒)通常需要的最低病毒载量阈值的研究结果。在所研究的病例中,有4300多例病例提供了连续样本。利用这些样本来追踪咽喉部的病毒载量数据,他们能够对感染过程中病毒载量的典型变化进行建模。他们随后在他们的数据中寻找明显的差异,特别是与不同年龄组、疾病严重程度和病毒变体有关的差异。
年龄在20至65岁之间的SARS-CoV-2阳性个体的病毒载量水平没有明显的差异:平均咽拭子样本含有大约250万SARS-CoV-2基因组拷贝。在非常年幼的儿童(0至5岁)中发现病毒载量最低。病毒载量水平从大约80万病毒基因组拷贝开始,随着年龄的增长而增加,并在较大的儿童和青少年中接近成人水平。
10.Science:揭示四种令人担忧的新冠病毒变体逃避免疫反应机制
doi:10.1126/science.abh1139
导致COVID-19的冠状病毒SARS-CoV-2正在全球肆虐。这种病毒的变体携带的突变能够让它逃避天然产生的或通过疫苗接种产生的一些免疫反应。在一项新的研究中,来自美国、德国和荷兰的研究人员揭示了这些逃逸突变如何发挥作用的关键细节。他们利用结构生物学技术高分辨率地描绘了重要的中和抗体类别如何与SARS-CoV-2的原始流行毒株结合,以及这一结合过程如何被在巴西、英国、南非和印度首次发现的新变体中的突变所破坏。相关研究结果于2021年5月20日在线发表在Science期刊上,论文标题为“Structural and functional ramifications of antigenic drift in recent SARS-CoV-2 variants”。
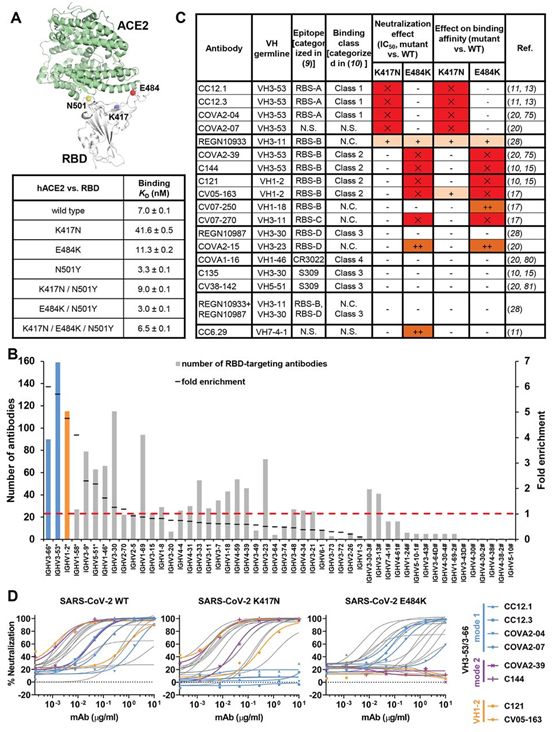
新出现的SARS-CoV-2变体逃脱了两种主要的中和抗体,图片来自Science, 2021, doi:10.1126/science.abh1139。
令人关注的SARS-CoV-2变体包括英国的B.1.1.7变体、南非的B.1.351变体、巴西的P.1变体和印度的B.1.617变体。这些变体中的一些似乎比原始的SARS-CoV-2毒株更具感染性。最近的研究已发现,通过自然感染原始毒株或通过疫苗接种产生的抗体反应在中和这些变体毒株方面效果较差。
在这项研究中,这些作者主要关注SARS-CoV-2刺突蛋白上的三种突变:K417N、E484K和N501Y。这些突变中的单个或它们的组合在大多数主要的SARS-CoV-2变体中都有发现。这三种突变都是在SARS-CoV-2的RBS上发现的,而RBS是这种病毒附着在宿主细胞上的地方。他们测试了主要类别的代表性抗体,这些抗体靶向RBS内部和周围的区域。他们发现,当这些突变存在时,这些抗体中有许多失去了有效结合和中和这种病毒的能力。利用结构成像技术,他们随后在原子水平分辨率下绘制出这种病毒的相关部分,以研究这些突变如何影响抗体本来会结合和中和这种病毒的位点。这项研究为COVID-19疫苗或原始大流行病毒株的自然感染激发的抗体往往无法有效抵抗这些令人担忧的变体提供了结构上的解释。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


