2024年8月Science期刊精华
来源:生物谷原创 2024-08-29 12:33
开发出一种创新技术,可在单分子水平上分析复杂生物过程的动态变化、新研究揭示迄今为止发现的最大蛋白的合成机制、在出生之前,哺乳动物大脑中的脑细胞如何形成精确神经回路
2024年8月份即将结束,8月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:开发出一种创新技术,可在单分子水平上分析复杂生物过程的动态变化
doi:10.1126/science.adn5371
在一项新的研究中,由乌普萨拉大学 Sebastian Deindl 教授领导的一个研究团队开发出一种开创性的方法,大大提高了在单分子水平上观察和分析复杂生物过程的能力。相关研究结果发表在2024年8月23日的Science期刊上,论文标题为“Massively parallel analysis of single-molecule dynamics on next-generation sequencing chips”。
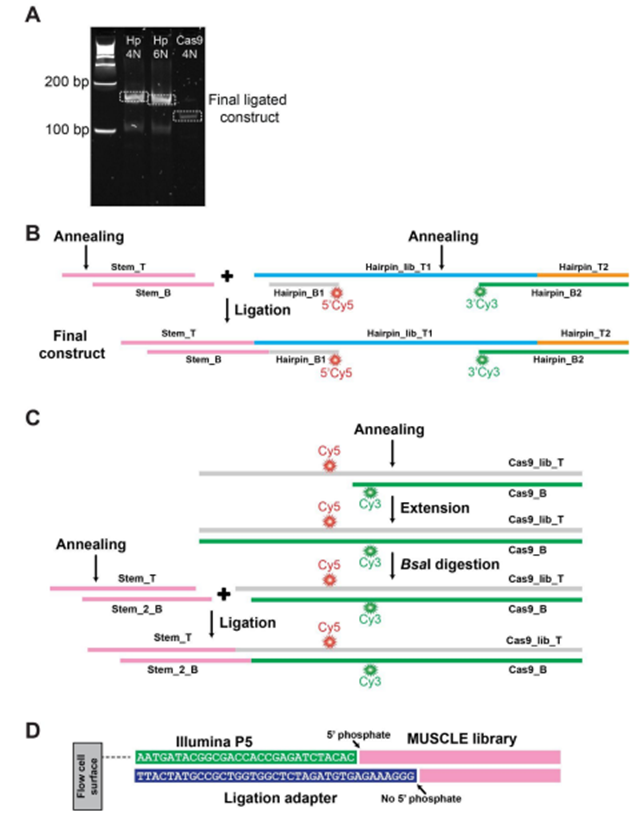
图片来自Science, 2024, doi:10.1126/science.adn5371
这种方法被称为 MUSCLE(MUltiplexed Single-molecule Characterization at the Library scalE,库级多重单分子表征),它为更准确、更全面地研究生物系统打开了大门,而在生物系统中,了解分子行为的全貌至关重要。预计它将对作为序列或化学空间的功能的复杂分子动力学研究产生深远影响,使得人们能够探索生物学中以前未知的领域。
MUSCLE 将单分子荧光显微镜的机理研究与新一代测序的高通量能力相结合,解决了这一难题。这个工作流程的第一步是将荧光标记分子文库附着在称为 Illumina MiSeq 流动池的表面上。然后使用 3D 打印适配器将该流动池放置到单分子荧光显微镜上,这样就可以在多个视野中观察单个分子的实时动态。成像后,对流动池进行标准的 Illumina 测序,从先前观察到的分子中生成相同拷贝的簇。然后,根据这些簇在流动池上的位置,将其与相应的分子进行匹配。
2.刷新生物蛋白尺寸极限!Science:新研究揭示迄今为止发现的最大蛋白的合成机制
doi:10.1126/science.ado3290
在一项突破性的研究中,加州大学圣地亚哥分校斯克里普斯海洋学研究所的研究团队揭示了一种名为小定鞭金藻(Prymnesium parvum)的微藻如何生产复杂毒素的秘密。在这个过程中,他们发现了一个生物学领域中前所未见的巨大蛋白质,被命名为PKZILLA-1,这一发现不仅刷新了蛋白质尺寸的记录,还打开了新药研发和新材料探索的大门。相关研究结果发表在2024年8月9日的Science期刊上,论文标题为“Giant polyketide synthase enzymes in the biosynthesis of giant marine polyether toxins”。
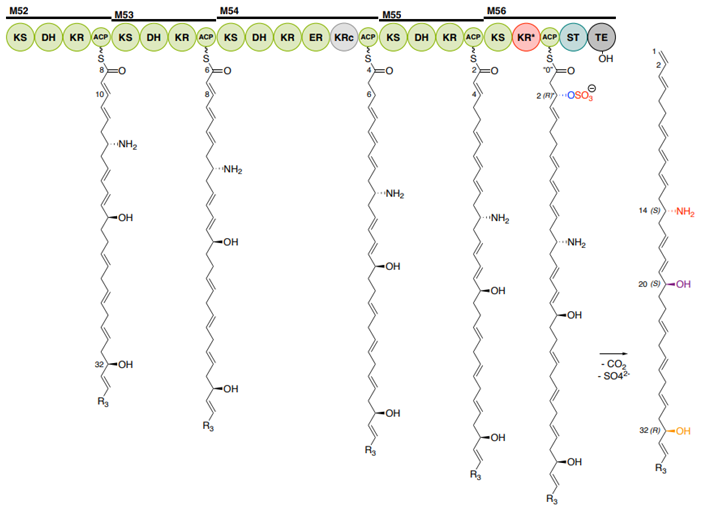
图片来自Science, 2024, doi:10.1126/science.ado3290
在本研究中,研究小组首先对小定鞭金藻的基因组进行测序,寻找与毒素合成相关的基因。但并未能找到答案,这促使他们更换专门用于发现超长基因的技术来测序,最终发现了小定鞭金藻使用巨型基因生产巨型有毒分子的秘密。
在确认了PKZILLA-1和PKZILLA-2基因后,研究者分析了这些基因如何指导毒素的合成。当他们拼凑出PKZILLA蛋白的全貌时,其巨大尺寸令人震惊。PKZILLA-1蛋白的质量高达4.7兆道尔顿,而PKZILLA-2也达到了3.2兆道尔顿,远超普通蛋白质的平均质量。这些蛋白本质上是酶,能够催化化学反应,研究者通过计算验证了这两种酶触发的239个化学步骤,与小定鞭金藻毒素的结构完全一致。
3.早在生命最初阶段,细胞就已经自发活动,铺设学习之路!Science揭秘:在出生之前,哺乳动物大脑中的脑细胞如何形成精确神经回路
doi:10.1126/science.adh7814
人类的学习之旅始于大脑内部错综复杂的细胞网络。例如,当第一次看到并识别狗狗的特征——四条腿、毛皮、尾巴,大脑中的神经元开始协同工作,响应编码这些特征的信号,这使得幼儿学会了辨认小狗。然而,在个体出生前,甚至在任何实际经验和感官输入引导细胞回路构建之前,大脑就已经在悄然搭建其基础架构。那么,这一切是如何启动的呢?
耶鲁大学的研究团队在最新研究中揭示了答案:在经验尚未来得及塑形大脑之前,脑细胞就已按照一套固有的规则开始组织成神经网络。这一规则与后期经验驱动下的神经连接形成相同,即“一起活跃的细胞会联结在一起”。不过,这里的驱动力并非外部经验,而是源自细胞内部的自发活动。相关研究结果发表在2024年8月16日的Science期刊上,论文标题为“Hebbian instruction of axonal connectivity by endogenous correlated spontaneous activity”。
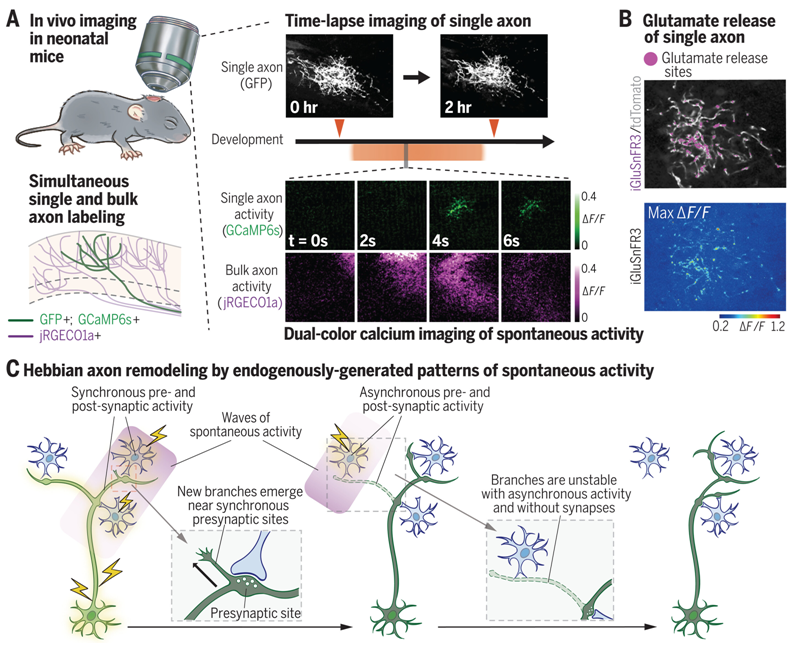
赫伯轴突重塑
图片来自Science, 2024, doi:10.1126/science.adh7814
本研究聚焦于小鼠的视网膜神经节细胞,这些细胞向大脑中的上丘区投射信号,与下游神经元建立联系。研究人员监测了单个视网膜神经节细胞的活性变化、以及其发育过程中的结构演变。此外,他们还对眼睛尚未睁开的清醒新生鼠的细胞活动进行了检测。先进显微技术与荧光蛋白的结合应用,让追踪细胞活动及其形态改变成为可能。
以往研究已证实,即使在感官体验出现前,比如人类胎儿期或幼鼠睁眼前数天,神经元的自发活动会相互关联,形成波动。在本项研究中,研究人员观察到,当单个视网膜神经节细胞的活动与邻近细胞的自发波动高度一致时,该细胞的轴突——负责细胞间连接的部分,会生发出新的分支;反之,若活动同步性低,则轴突分支将被修剪。
共同通讯作者、耶鲁大学医学院神经科学助理教授Liang Liang指出:“当细胞同步放电时,它们之间的联系得到强化。轴突的新分支有助于视网膜神经节细胞与上丘中同步活跃的神经元建立更多连接。”这一发现呼应了心理学家Donald Hebb在1949年提出的“赫伯定律”——当一细胞反复激发另一细胞放电,两者的联系就会增强。
4.Science:我国科学家发现β-d-甘露庚糖是在不同生物界都存在的免疫激动剂
doi:10.1126/science.adk7314
细菌的小分子代谢物,如腺苷-二磷酸-d-甘油-β-d-甘露庚糖(ADP-heptose)及其衍生物,是哺乳动物体内有效的先天性免疫激动剂。ADP-heptose是由具有异构酶、激酶、磷酸酶和核苷酸转移酶活性的 NDP-庚糖生物合成酶(HBE)催化,通过四步接力从 7-磷酸双链庚糖(S7P)合成的。关于β-d-甘露庚糖生物合成的知识仅限于细菌,而非细菌的HBE尚未被描述。
在一项新的研究中,中国科学院微生物研究所陈义华(Chen Yihua)与北京生命科学研究所的邵峰(Shao Feng)研究员和吴边(Wu Bian)研究员及其同事们合作,扩大了HBE的分布范围和NDP-庚糖的结构多样性。相关研究结果发表在2024年8月9日的Science期刊上,论文标题为“The β-d-manno-heptoses are immune agonists across kingdoms”。
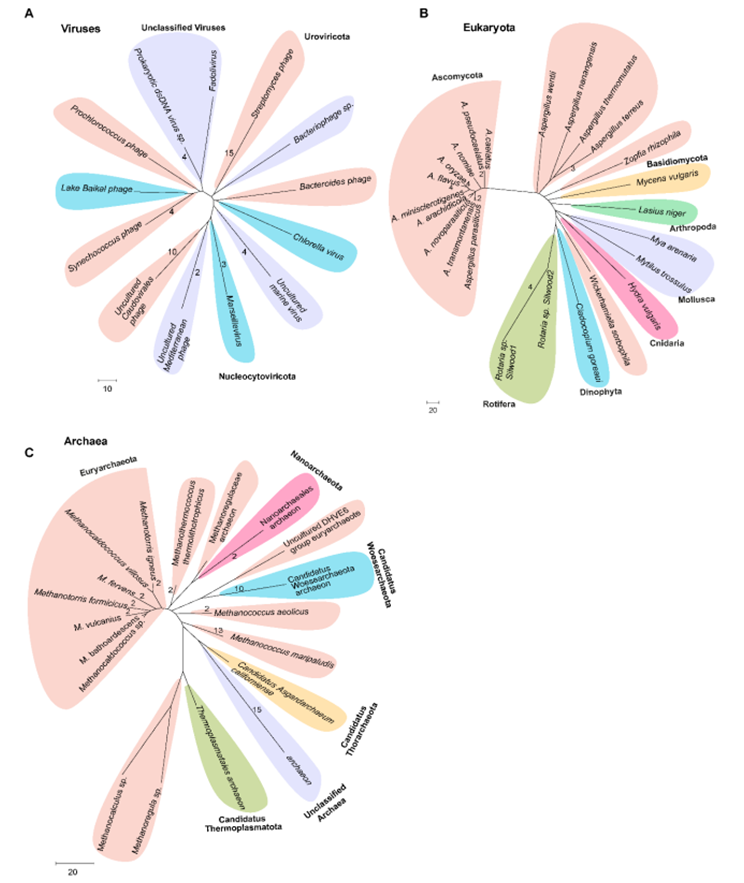
图片来自Science, 2024, doi:10.1126/science.adk7314
他们发现β-d-甘露庚糖是在不同生物界中存在的小分子病原体相关分子模式,能激活α-蛋白激酶1(ALPK1)依赖的先天性免疫信号级联。他们发现,功能性 HBE 广泛分布于细菌、古生菌、真核生物和病毒中。他们发现,庚糖核苷酸转移酶的标志是一个保守的STTR5基序,它不仅能合成ADP-heptose,还能合成胞苷-二磷酸(CDP)-庚糖和尿苷-二磷酸(UDP)-庚糖。
他们发现,在人类细胞和小鼠细胞中,CDP-庚糖和 UDP-庚糖都是能触发 ALPK1 依赖性免疫反应的激动剂,比 ADP-庚糖更强,而且 ADP-庚糖在古细菌中也能产生,这验证了它的先天免疫激动剂功能。
5.Science:利用低温电镜破译人类蛋白复合物TIP60的详细结构和行为
doi:10.1126/science.adl5816
为了转录基因中包含的信息,或者修复 DNA 中每天发生的数十次断裂,我们的酶必须能够直接访问DNA 以执行其功能。然而,在细胞核中,这种访问是有限的,因为 DNA 链通常像线轴上的线一样紧紧盘绕在组蛋白周围。
在一项新的研究中,来自劳伦斯伯克利国家实验室、加州大学伯克利分校、西雅图系统生物学研究所和拉瓦尔大学的研究人员如今对能够访问已被包裹的DNA的蛋白复合物TIP60有了更好的了解。了解TIP60 的详细结构和行为,就能深入了解这种蛋白复合物在其中发挥作用的多种疾病,如阿尔茨海默病和多种癌症。相关研究结果于2024年8月1日在线发表在Science期刊上,论文标题为“Structural insights into the human NuA4/TIP60 acetyltransferase and chromatin remodeling complex”。
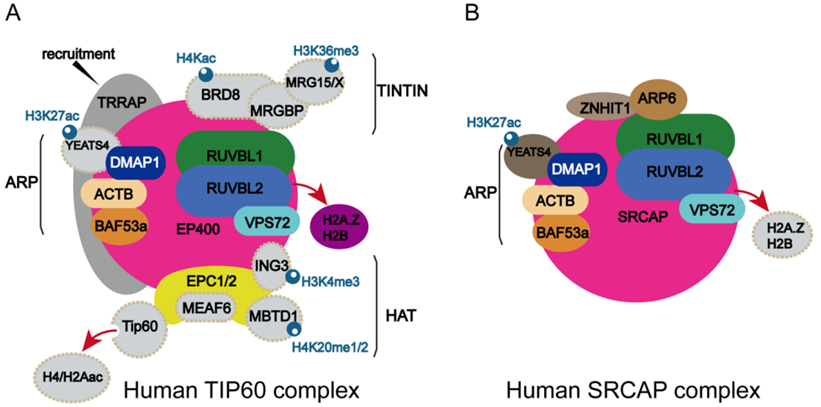
图片来自Science, 2024, doi:10.1126/science.adl5816
论文共同通讯作者、加州大学伯克利分校教授Eva Nogales说,“这项合作研究以一种强有力的方式将结构和功能测试结合在一起,让我们了解了这种复杂的大分子组装如何执行其调节对我们的基因组进行阅读的工作。人类 TIP60 的结构揭示了进化如何将两种不同的分子功能合并成单个复合物,重新调整结构模块的组合方式以适应其双重功能。”
研究者能够研究这种由 17 种蛋白组成的复合物的结构及其各组分之间的相互作用。他们采用了多种方法,包括在加州大学伯克利分校Nogales实验室进行的高分辨率低温电镜实验。这种技术能让科学家们观察到原子尺度的蛋白结构。
6.自由漂浮且瞬息即逝的“外星基因”?!Science:细菌利用一种逆转录酶将非编码 RNA转化为新的基因,有效抑制病毒复制
doi:10.1126/science.adq0876
自 20 世纪 60 年代首次破译遗传密码以来,我们的基因就像一本打开的书,其中蕴含的生命蓝图对科学家来说变得越来越清晰。通过对染色体上的碱基序列进行解析,我们能够识别基因并理解遗传变异如何影响健康状态。这条生命的基本法则普遍适用于所有生命体,从最微小的细菌到复杂的人类。
然而,一项最新的研究揭示,细菌或许并不遵循这一传统规则,它们能够创造出游离且瞬息即逝的基因,这一发现暗示了在我们的基因组之外可能存在类似的基因结构。相关研究结果于2024年8月9日在线发表在Science期刊上,论文标题为“De novo gene synthesis by an antiviral reverse transcriptase”。

图片来自Science, 2024, doi:10.1126/science.adq0876
长久以来,细菌与病毒之间的战争持续上演,病毒企图将自己的遗传物质注入细菌体内,而细菌则演化出诸如CRISPR这样的精妙防御机制来抵御入侵。许多细菌的防御策略至今未被完全探索,但它们可能蕴藏着新的基因编辑工具。
Sternberg与Tang所研究的细菌防御系统显得异常独特:它涉及到一种未知功能的RNA片段以及一种逆转录酶——一种能够以RNA为模板合成DNA的酶。Tang指出,大多数细菌的防御机制是直接破坏病毒DNA,因此,“我们对这种通过DNA合成来保护自身基因组的方式感到困惑。”
Sternberg团队由此发现,该防御系统编码了一种全新的免疫途径,逆转录酶对非编码RNA进行滚环逆转录,生成新的基因。逆转录酶在非编码RNA上的模板跳跃导致了一系列串联重复的cDNA产生,在病毒感染后,这些cDNA转变成双链cDNA。尤为显著的是,这一DNA产物编码了一个几乎无限长的开放阅读框(ORF)基因,其表达可抑制细胞生长,进而限制病毒的扩散。
7.干细胞移植新革命!Science:破坏c-Kit可阻止胞啃作用,促进更多的造血干细胞进入血液
doi:10.1126/science.adp2065
造血干细胞(HSC)移植作为治疗癌症、血液疾病及自身免疫性疾病的救命稻草,其疗效与造血干细胞的质量和数量密切相关。近日,阿尔伯特-爱因斯坦医学院的科研团队在小鼠模型中揭开了提高HSC移植成功率的潜在路径,为临床应用带来了新的希望。相关研究结果发表在2024年8月9日的Science期刊上,论文标题为“Regulation of the hematopoietic stem cell pool by C-Kit–associated trogocytosis”。

C-Kit依赖性胞啃作用调节造血干细胞保留在壁龛中
图片来自Science, 2024, doi:10.1126/science.adp2065
论文共同通讯作者Britta Will博士说,“少量HSC会自然地从骨髓迁移到血液中,但我们对这一过程的调控机制知之甚少。本次研究为我们带来了深刻洞见,并指明了优化HSC动员策略的方向。”
研究团队推测,造血干细胞(HSC)表面蛋白的变化可能会影响它们离开骨髓的倾向。通过对小鼠HSC的分析,他们发现相当一部分HSC携带了与巨噬细胞(一种免疫细胞)相关的表面标记。实验显示,具有这些标记的HSC多留驻骨髓,而无标记的HSC则会在动员药物作用下从骨髓中释放。
进一步实验揭示,HSC与巨噬细胞接触时,会发生胞啃作用:一方细胞摄取另一方的膜片段并将其融入自身。那些表面表达高水平c-Kit蛋白的造血干细胞能够进行胞啃作用,由此吸收巨噬细胞的表面蛋白,增加其在骨髓中的滞留概率。基于此,研究人员认为抑制c-Kit可以中断胞啃作用,从而动员更多HSC用于移植。
8.艾滋病治疗重大进展!Science:实验性单次注射疗法展现惊人潜力,能够在长达30周内显著压制非人灵长类动物体内的SHIV水平
doi:10.1126/science.adn5866
在一项前沿研究中,来自俄勒冈健康与科学大学和加州大学旧金山分校的科学家们取得了突破性成果,他们发现一种实验性的单一注射能够在长达30周的时间内显著抑制非人灵长类动物体内的猿猴/人类免疫缺陷病毒(SHIV)水平。相关研究结果发表在2024年8月9日的Science期刊上,论文标题为“Engineered deletions of HIV replicate conditionally to reduce disease in nonhuman primates”。
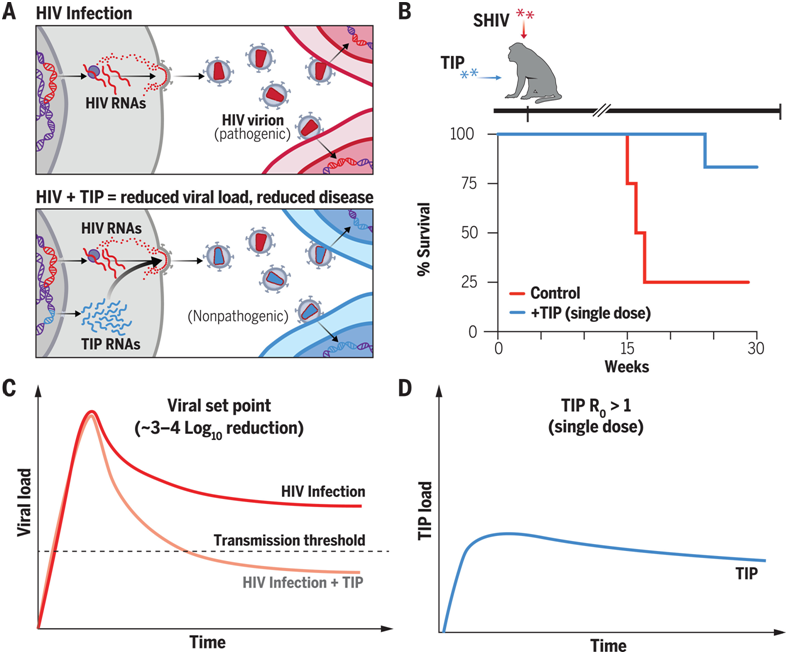
单剂量HIV治疗:TIP通过有条件复制减少非人类灵长类动物的疾病
图片来自Science, 2024, doi:10.1126/science.adn5866
SHIV是一种混合了猿猴免疫缺陷病毒(SIV)与人类免疫缺陷病毒(HIV-1)基因片段的病毒,常用于研究HIV的不同基因功能以及病毒与宿主的互动。本研究的发现意味着实验室合成的注射剂或能成为一种更简便、持久的替代方案(当前HIV感染者的标准治疗需要严格的用药依从性)。
研究人员发现,治疗性干扰颗粒(TIPs)能够将非人灵长类动物体内的SHIV水平降低至少1000倍,在六只接受治疗的动物中,有五只的病毒水平显著下降。在一只接受治疗的动物中,SHIV含量降低至检测不到的水平。TIPs是由实验室设计的非致病性HIV病毒片段,其快速繁殖,与HIV竞争资源,旨在抑制感染者体内的病毒活性。
论文的共同通讯作者、加州大学旧金山分校的病毒学家Leor Weinberger博士在2000年代初期首次通过计算模型提出了TIP的概念,并在后续的实验室研究和小鼠实验中验证了这一理论。共同作者、俄勒冈健康与科学大学的Nancy Haigwood博士表示:“我们看到的疾病进程改变是前所未有的。如果TIP能在人类HIV感染中产生与我们在非人灵长类动物研究中观察到的相同效果,那么这将开启一条新的治疗途径,可能使人们无需终身服药。这是令人振奋的。”
9.Science:新研究揭示Trpv1+伤害感受神经元控制肠道中的调节性T细胞群体
doi:10.1126/science.adk1679
胃肠道是一种复杂的感觉器官,它整合了神经元、上皮细胞、微生物和免疫信号。在这一框架内,肠道神经系统、外在感觉神经节和自主神经节以及肠道驻留免疫细胞之间的相互作用维持着肠道的生理平衡,并协调抵抗病原体的屏障防御。神经免疫交叉对话失调可能是食物过敏、慢性内脏疼痛和炎症性肠病等主要消化道疾病的根源。
尽管取得了显著进展,但人们对肠道神经系统和免疫系统之间的相互作用仍然知之甚少。部分原因是在体内操纵这些相互作用存在局限性,而且肠道内神经元类别和免疫细胞类型的多样性导致了许多潜在的细胞相互作用。化学遗传学(chemogenetics)提供了通过 DREADDs(designer receptors exclusively activated by designer drugs, 专门由设计药物激活的设计受体)控制特定神经元细胞类型活性的方法。例如,神经元表达 hM3Dq(一种激活型 DREADD)可通过给送它的配体——氯氮平 N-氧化物(clozapine N-oxide, CNO),来激活神经元。
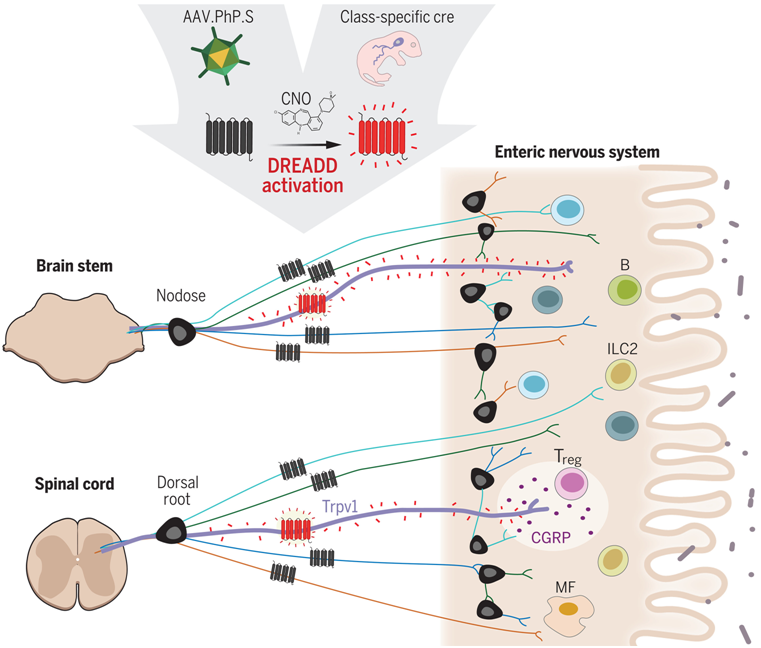
化学遗传学鉴定伤害感受神经元与肠道免疫细胞之间的通信
图片来自Science, 2024, doi:10.1126/science.adk1679
在一项新的研究中,来自哈佛医学院的研究人员采用一种化学遗传筛选方法来分析和绘制肠道中神经成分和免疫成分之间的相互作用。相关研究结果发表在2024年8月2日的Science期刊上,论文标题为“A chemogenetic screen reveals that Trpv1-expressing neurons control regulatory T cells in the gut”。
研究者利用八种不同的神经元 Cre 小鼠品系,结合新生小鼠时给送 Cre 依赖性 AAV.PhP.S-DIO-hM3Dq 病毒,选择性地靶向不同的迷走神经节、背根神经节 (DRG) 和肠道神经元亚群。给这些小鼠注射 CNO 激活神经元后,他们通过流式细胞术对回肠、盲肠和结肠肠道组织进行了广泛的免疫表型分析。
他们的分析表明在神经元激活后,免疫细胞群发生了明显变化。以 Nos1 表达为标志的胆碱能神经元调节TH17细胞样细胞。表达 ChAT 的胆碱能神经元可调节中性粒细胞。激活表达 Trpv1(Trpv1+)的伤害感受神经元(nociceptive neuron)具有最广泛的影响,可下调结肠中表达转录因子 RORγ 的髓样细胞群体和调节性 T细胞(Treg)。Trpv1+伤害感受神经元的激活会诱导 Treg 细胞发生独特的转录变化,并抑制它们的增殖。对不同神经元进行神经解剖学聚焦激活和消融的方法显示DRG中的Trpv1+伤害感受神经元介导了这种Treg表型,而迷走神经节中的Trpv1+神经元则没有介导这种表型。利用基因缺陷小鼠,他们发现这种神经免疫相互作用需要CGRP及其受体 RAMP1。
10.皮肤细胞变身神经元!Science:科学家利用细胞重编程技术,成功构建出研究晚发性阿尔茨海默病的体外模型
doi:10.1126/science.adl2992
在一项新的研究中,华盛顿大学医学院的研究团队成功研发了一种新颖方法,能够模拟阿尔茨海默病进程中衰老对神经元的影响,并且无需依赖侵入性的大脑活检。这一突破性进展有望深刻影响我们对这一疾病的理解,并为开发创新疗法开辟道路。相关研究结果发表在2024年8月2日的Science期刊上,论文标题为“Modeling late-onset Alzheimer’s disease neuropathology via direct neuronal reprogramming”。

图片来自Science, 2024, doi:10.1126/science.adl2992
研究者们采用了一种创新策略,将阿尔茨海默病晚期发病型患者(通常在65岁以后发病)的皮肤细胞转化为神经元,首次在实验室条件下精确再现了该疾病的关键病理特征,包括β淀粉样蛋白斑块、tau蛋白纤维缠结和神经元死亡。
通过深入分析这些转化后的神经元,研究团队发现,特定的逆转录转座子——那些在基因组中活跃跳跃的DNA片段——其活性随年龄增长而变化,与阿尔茨海默病晚期发病型的进展紧密相关。这一发现为靶向治疗提供了新方向。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


