造血干细胞研究进展(第10期)
来源:本站原创 2021-12-31 23:59
2021年12月31日讯/生物谷BIOON/---造血干细胞(hemapoietic stem cell, HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少。现代医学中,造血干细胞在骨髓移植
1988年法国的Gluckman教授在国际上率先成功采用脐血造血干细胞移植,救治了一名贫血患儿,标志着脐带血造血干细胞移植时代的开启。全球现每年约进行6万例骨髓移植术,其中使用自体和同种异体造血干细胞完成骨髓移植术的患者人数分别为近3.5万和2.5万例。
造血干细胞的来源主要包括骨髓、外周血和脐带血。如今,“骨髓移植”已渐渐被“外周血造血干细胞移植”代替。也就是说,现在捐赠骨髓已不再抽取骨髓,而只是“献血”了。 脐带血是胎儿娩出断脐后残留在脐带和胎盘中的血液,富含造血干细胞,可用于治疗急、慢性白血病和某些恶性肿瘤等多种重大疾病。
基于此,小编针对近年来造血干细胞研究取得的进展进行一番梳理,以飨读者。
1.Nat Aging:隐性转录升高与哺乳动物干细胞衰老有关
doi:10.1038/s43587-021-00091-x
尽管可见的衰老迹象通常是明确无误的,但揭开触发它们的原因一直是一个相当大的挑战。在一项新的研究中,来自美国贝勒医学院、布朗大学、德州农工大学和斯坦福大学的研究人员发现一种之前已被描述过的与酵母和线虫的衰老有关的称为隐性转录(cryptic transcription)的细胞现象在衰老的哺乳动物干细胞(包括小鼠造血干细胞、神经干细胞和人类间充质干细胞)中升高了。相关研究结果于2021年8月2日在线发表在Nature Aging期刊上,论文标题为“Altered chromatin states drive cryptic transcription in aging mammalian stem cells”。
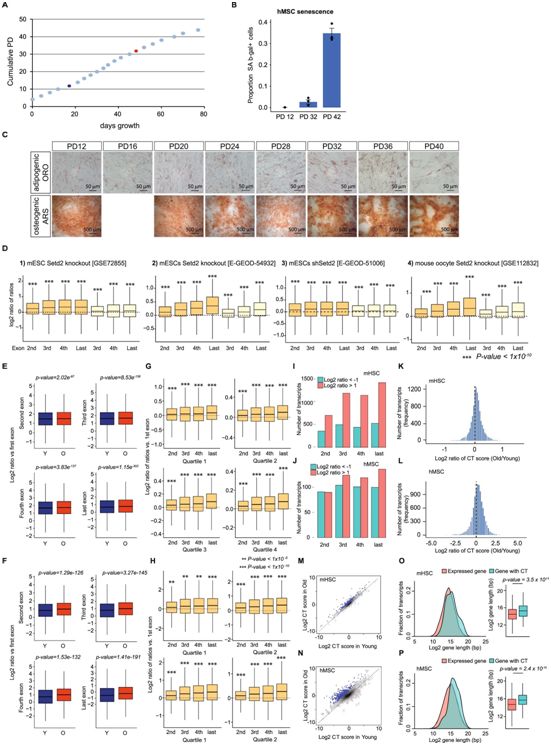
对衰老的小鼠造血干细胞和人类间充质干细胞的RNA测序数据的进一步分析。图片来自Nature Aging, 2021, doi:10.1038/s43587-021-00091-x。
论文通讯作者、贝勒医学院赫芬顿衰老中心分子与人类遗传学助理教授Weiwei Dang博士说,“在以前的研究工作中,我们已发现酵母和线虫中的隐性转录不仅是衰老的标志,也是一个原因。减少这些有机体中这种异常转录的数量,可以延长它们的寿命。”
2.Nat Cell Biol:化疗后感知垃圾DNA或能增强机体的血液再生
doi:10.1038/s41556-021-00707-9
近日,一篇发表在国际杂志Nature Cell Biology上题为“Chemotherapy-induced transposable elements activate MDA5 to enhance haematopoietic regeneration”的研究报告中,来自马克斯普朗克免疫生物学和表观遗传学研究所等机构的科学家们通过研究发现,造血干细胞或能利用垃圾DNA片段中的RNA分子在化疗后增强其自身的激活。
造血干细胞位于造血层级的顶端,其能产生大多数的血液细胞,包括免疫细胞等;在正常情况下,造血干细胞能在骨髓中保持休眠状态从而保持其长期的自我更新潜力,并能防止干细胞枯竭。然而在化疗后,其会被迫退出静止状态并开始循环;研究者Eirini Trompouki说道,造血干细胞会通过开始增殖来对化疗产生反应,如今我们知道,炎性信号对于造血干细胞的激活至关重要,但我们并不是能完全理解这一过程发生背后的分子机制。
有意思的是,研究者观察到,除了经典编码基因的RNAs之外,其它的RNA分子还会在患者化疗后在造血干细胞中被转录;这些RNAs中的一部分源于激活或非激活的转座子元件;转座子元件是诸如病毒或细菌等病原体的残留物,其会通过数百万年的进化整合到宿主的基因组中;研究人员通常认为这些在人类和小鼠基因组中占三分之一但似乎缺乏特定功能的广泛的遗传物质属于垃圾DNA的类别。
3.Nat Commun:重大进展!首次在胶质母细胞瘤中发现了狼狈为奸的造血干细胞
doi:10.1038/s41467-021-23995-z
在一项新的研究中,来自德国癌症协会(DKTK)的研究人员首次在胶质母细胞瘤中发现了造血干细胞。这些造血干细胞促进了癌细胞分裂,同时也抑制了针对这种肿瘤的免疫反应。这一惊人的发现可能为开发针对这些恶性脑瘤的更有效的免疫疗法提供了新的可能性。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Tumor-associated hematopoietic stem and progenitor cells positively linked to glioblastoma progression”。
在217个胶质母细胞瘤、86个WHO II级和III级星形细胞瘤的组织样本以及17个健康脑组织样本中,这些作者使用计算机辅助转录分析来绘制细胞组成的轮廓。这些组织样本直接取自切除边缘---残留的肿瘤细胞和免疫细胞相遇的地方。
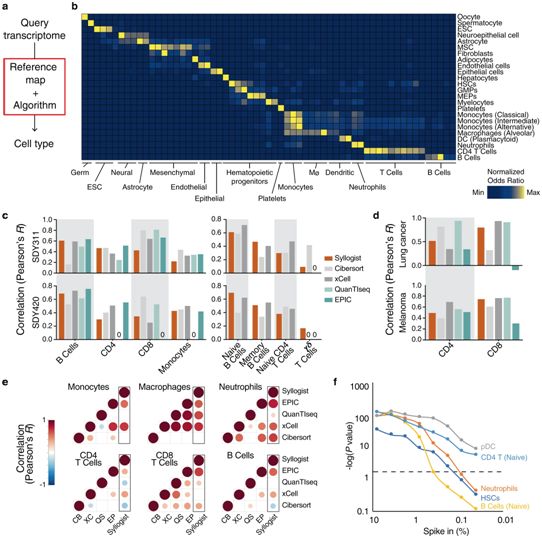
利用转录组估计细胞类型,图片来自Nature Communications, 2021,doi:10.1038/s41467-021-23995-z。
更令人惊讶的是,这些造血干细胞似乎具有致命的特性:它们抑制免疫系统,同时刺激肿瘤生长。当这些作者将肿瘤相关的造血干细胞与胶质母细胞瘤细胞在同一培养皿中培养时,癌细胞分裂增加。同时,这些癌细胞表面产生了大量的称为“免疫刹车(immune brake)”的PD-L1分子。
4.Nat Commun:新方法富集造血干细胞,有望培育出更好的骨髓嵌合小鼠
doi:10.1038/s41467-021-23763-z
为了研究人类健康和疾病中的免疫系统,科学家们通常使用经过基因操纵的小鼠造血干/祖细胞(hematopoietic stem and progenitor cell, HSPC)作为一个强大的模型系统。这些研究在与一些人类疾病的斗争中极具价值。然而,目前的实验方案是复杂的、耗时的和昂贵的。
在一项新的研究中,来自日本东京大学、筑波大学和英国牛津大学的研究人员开发出一种新的技术,有可能克服与这些称为骨髓(BM)嵌合小鼠的模型相关的限制。该方法允许科学家们观察和研究基因改变如何影响生理环境中的免疫细胞表型和行为。相关研究结果于2021年6月11日发表在Nature Communications期刊上,论文标题为“Non-conditioned bone marrow chimeric mouse generation using culture-based enrichment of hematopoietic stem and progenitor cells”。
这些作者开发出一种特定的细胞培养基,用于在实验室中培养HSPC。这种培养基补充了某些称为促血小板生成素(thrombopoietin,TPO)和干细胞因子的刺激分子,促进HSPC在培养基中的生长。
此外,这些作者解释了这些培养的HSPC如何能够成功地移植到非条件免疫能力(non-conditioned immunocompetent)的受体小鼠体内。这意味着宿主小鼠不需要接受辐射,从而消除了与此过程相关的负面实验和毒性影响。
5.Nature子刊:偏向性信号传递使得普乐沙福更有效地动员造血干细胞
doi:10.1038/s42003-021-02070-9
有一些药物可以从骨髓中动员造血干细胞,以便在治疗后将动员的造血干细胞送回相同患者的体内。随后,它们产生新的免疫细胞,使身体能够再次对抗来袭的威胁。但此前,我们对这些药物的工作原理缺乏详细了解。
如今,来自丹麦哥本哈根大学的研究人员在小鼠身上进行了一项新的研究,展示了这样的药物是如何在细胞层面上发挥作用的,而且令人惊讶的是,在两种测试的药物---AMD11070和普乐沙福(plerixafor)---中,尽管AMD11070在名义上似乎这两种药物中最有效的,但是,他们发现普乐沙福却比AMD11070更有效地动员造血干细胞。这一发现可能不仅仅有助于改善造血干细胞移植,而且还可能在未来开发出改进的药物。相关研究结果近期发表在Communications Biology期刊上,论文标题为“Biased action of the CXCR4-targeting drug plerixafor is essential for its superior hematopoietic stem cell mobilization”。
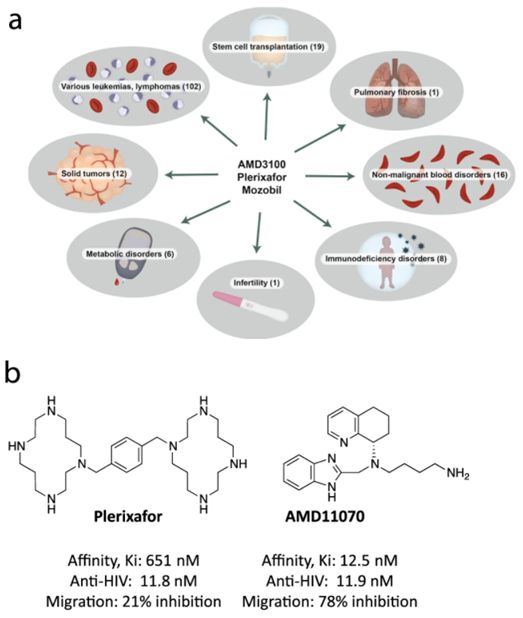
涉及普乐沙福的临床试验,以及普乐沙福与AMD11070的比较,图片来自Communications Biology, 2021, doi:10.1038/s42003-021-02070-9。
这些作者测试的这两种药物通过充当CXCR4受体拮抗剂来动员造血干细胞。这意味着它们抑制或减少这种受体的活性。一些药物靶向这种受体,包括抑制HIV病毒复制的药物。
6.Stem Cells:衰老生态位可使造血干细胞的“返老还童”?
doi:10.1002/stem.3372
造血干细胞的衰老可引起与衰老相关的白血病以及相关的免疫重构。在体外使用Cdc42(可导致造血干细胞衰老)活性特异性抑制剂治疗衰老的造血干细胞后,将其移植到年轻的受者体内后仍能保持活力。
在该研究中Novella Guidi教授团队确定了衰老生态位对体外再生衰老星状细胞功能的影响,结果表明,衰老生态位抑制了体外再生造血干细胞的功能,这至少在一定程度上与衰老生态位中发现的低水平细胞因子骨桥蛋白有关,这为我们解决衰老生态位对衰老造血干细胞在体内持续恢复功能的影响提供了思路。
年轻化的老年造血干细胞移植到年轻受体后,其持续的年轻功能依赖于干细胞内在和干细胞外在因素(生态位/微环境)的结合。当再生的老年造血干细胞被移植到年轻小鼠体内时,其衰老的一些特征又会回到衰老的表型。对于某些表型来说,这可能是由于老年生态位中骨桥蛋白水平的降低。因此,为了在体内恢复衰老的造血干细胞,需要考虑生态位对再生造血干细胞的影响。
7.Stem Cell Res:胞外特殊的层粘连蛋白或能调节多能干细胞的造血潜能
doi:10.1016/j.scr.2021.102287
诱导多能干细胞(iPSCs)的神奇之处在于其能够大量增殖并分化为所有类型的细胞,以便最初少量的iPSCs能够用于制造大量的机体细胞;然而,一些细胞已经被证明要比其它细胞更加容易产生和制造,而这对于ipsCs的研究转化到临床疗法中的成本和花费或许具有重大影响;近日,一篇刊登在国际杂志Stem Cell Research上题为“Extracellular laminin regulates hematopoietic potential of pluripotent stem cells through integrin β1-ILK-β-catenin-JUN axis”的研究报告中,来自日本京都大学等机构的科学家们通过研究发现,一种广泛存在于人类机体中并用于iPSCs疗法的特殊分子—层粘连蛋白(laminin)或许会影响ipsCs的造血分化。
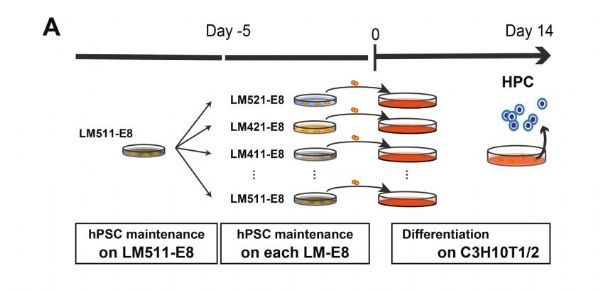
胞外层粘连蛋白支架或能通过控制典型的Wnt/β-连环蛋白信号通路来确定hPSCs的造血潜能。图片来源:Akinori Yuzuriha,et al. Stem Cell Research (2021). DOI: 10.1016/j.scr.2021.102287。
研究人员利用LM511-E8将iPSCs分化出了多种类型血细胞,包括他们给患者机体中输注的血小板等,这种分化的基础是研究者10多年前发现的Sac方法。Sac方法主要是针对iPSCs的造血分化,其能够遵循原条结构、中胚层、血管内皮的状态来产生造血祖干细胞。换句话说,这种方法能试图重现天然的造血作用从而产生造血祖细胞,而造血祖细胞是一种所有其它血细胞都能够衍生的细胞类型。然而这种方法并非没有缺陷,研究人员注意到,相比ipsCs的数量,他们所获得的造血祖细胞的数量相当少。
8.Nature 子刊:科学家揭秘造血干细胞的造血机制
doi:10.1038/s41467-021-22053-y
观遗传调节因子ASXL1、TET2和DNMT3A的体细胞突变在造血干细胞中被反复检测到。小鼠中TET2或DNMT3A的缺乏增强了LT-HSCs的自我更新,这表明TET2和DNMT3A的突变诱导造血细胞的克隆扩增,导致人类的克隆性造血。相比之下,小鼠中的ASXL1突变减少了HSCs的数量和功能。
基于此,来自日本东京都港区东京大学医学研究所细胞治疗学系的Makoto Suematsu 教授,带领团队将关于造血干细胞的相关研究以“Mutant ASXL1 induces age-related expansion of phenotypic hematopoietic stem cells through activation of Akt/mTOR pathway”为题,于2021年3月23日在线发表在《Nature Communications》杂志上。
该研究团队观察到年龄相关的造血表型增强,包括贫血、骨髓偏向性分化、低细胞骨髓和表面标记物定义的LT-HSCs在老年ASXL1-MT KI小鼠中的扩增。这些表型通过抑制Akt/mTOR途径得到部分挽救,表明ASXL1-MT诱导的Akt/mTOR途径的激活与造血系统的增强老化有关。此外,RNA-序列分析显示ASXL1-MT促进年龄相关模式的基因表达。这些结果表明ASXL1-MT可能通过激活Akt/mTOR途径促进HSC衰老。
这项工作最有趣的发现之一是将AKT鉴定为BAP1的非组蛋白靶标。BAP1被ASXL1-MT稳定并赋予增强的DUB活性,是一种已知的组蛋白H2A的DUB,也显示出脱去几个非组蛋白。以前已经证明,多个E3连接酶诱导磷酸化AKT的泛素化和降解,从而淬灭激活的AKT信号。相反,ASXL1-MT/BAP1复合物解除和稳定AKT,这导致Akt/mTOR通路的弱但可能连续的激活。因此,这些发现揭示了ASXL1-MT作为信号调节剂的功能,超出了其作为表观遗传调节剂的已知作用。另一方面,最近的一项研究表明,Asxl1缺失激活Akt/mTOR途径是由于Pten位点的表观遗传失调。因此,该研究团队不能完全排除ASXL1-MT也通过表观遗传依赖性方式激活Akt/mTOR途径的可能性。
总之,该研究团队表明ASXL1-MT与BAP1合作,以表观遗传学独立的方式激活Akt/mTOR途径。活化的Akt/mTOR途径导致PlT-HSC在老化过程中异常膨胀,占据HSc室。Akt/mTOR信号过度活跃还会导致线粒体激活、ROS过度产生、DNA损伤增加以及随后的造血干细胞功能障碍。pLT-HSCs的扩张以及ASXL1突变引起的DNA损伤的增加可导致CH的发展,导致造血系统恶性肿瘤的继发突变。Akt/mTOR途径的药理学抑制可能为携带ASXL1突变的先天性心脏病患者的预防性干预铺平道路。
9.PNAS:单细胞水平揭示造血干细胞扩增的动态图谱
doi:10.1073/pnas.2015748118
在脊椎动物中,胚胎发生期间产生的最早确定的造血干细胞和祖细胞(HSPC的)可以产生多种血液谱系并表现出自我更新的属性。为建立HSPC池,新生的HSPC将首先迁移到临时性的造血器官,称为胎肝(FL,在哺乳动物)或尾造血组织(CHT,在斑马鱼)。临床上,体外HSPC扩展是获得足够的可移植HSPC的可行方法,但在技术上仍然具有挑战性。因此,解码造血器官内HSPC扩展的复杂调控机制至关重要。
基于此,中科院动物研究所刘峰课教授团队在《PNAS》杂志上发表题为“A single-cell resolution developmental atlas of hematopoietic stem and progenitor cell expansion in zebrafish ”的研究论文。该研究团队揭示了人类胎儿肝脏与斑马鱼CHT之间发育性造血的保守性和差异性。
该研究团队使用单细胞RNA-seq(scRNA-seq)绘制了28,777个细胞的转录图谱,这些图谱是从跨越三个连续发育阶段的CHT中分选出来的。利用这些图谱,该研究团队表征了HSPC转录异质性,并鉴定了EC特异性调节剂G蛋白偶联受体182(Gpr182),其功能上以细胞类型和阶段特异性方式支持HSPC扩增。此外,对斑马鱼CHT和人类FL的跨物种分析揭示了进化过程中保守的细胞成分和转录程序。
接下来,该研究团队分析了转录组图谱,以评估发育中的CHT的分数动态和基因表达变化。从三个阶段细胞图谱的综合分析表明,大多数带注释的细胞簇进行重叠,但造血成分的分数动态地改变。HSPC和HSPC衍生的HC(单核细胞2,巨噬细胞和红细胞1)的比例随时间增加,但红血球祖细胞衍生的HC(早期粒细胞,早期单核细胞1和红细胞2)随时间逐渐降低,表明最终的HSPCs正在快速扩张和分化,而在发展中的CHT中,早期的确定性造血作用已被确定性的造血作用所取代。
最后,为了进一步确定gpr182是否在CHT-HSPC发育中发挥特定阶段的作用,当VDA衍生的HSPC在CHT中开始定植时,该研究团队在2 dpf后进行了gpr182的热激诱导。WISH结果显示的过表达gpr182在增强HSPC基因的表达CMY b。红细胞基因GATA1和髓样细胞基因PU.1,表明gpr182的正向调节在CHT造血中。考虑到斑马鱼VDA中的造血内皮(HE)/ HSPC形成受gpr182负调控,该研究团队在发生HSPC形成时以28 hpf的热休克诱导进行gpr182过表达,以验证其发生负面的监管作用。WISH结果显示,在36 hpf时,gpr182的过表达降低了VDA中cmyb的表达,这与先前研究中报道的表型相似。先前在小鼠中的研究报告说,EC分泌的趋化因子在引导HSPC迁移到CVP和促进HSPC增殖和分化中发挥作用。
10.JCO:CD19-CAR-T细胞治疗后的异基因造血干细胞移植可阻止相当一部分B-ALL患者出现疾病复发
doi:10.1200/JCO.20.02262
嵌合抗原受体(CAR)T细胞(CAR-T)免疫疗法将患者自身的T细胞进行基因改造,使之更有效地杀死癌症。靶向CD19的CAR-T细胞(下称CD19-CAR-T)在儿童和青少年(children and young adult, CAYA)B细胞急性淋巴细胞白血病(B-ALL)患者(下称CAYA B-ALL患者)中给送28天后,其缓解率高达100%。但是,有限的数据表明,复发的人数相当多。之前的一项研究发现,超过40%的人在13.1个月后复发。CD19-CAR-T细胞治疗后的异基因造血干细胞移植(alloHSCT)在改善B-ALL CAYA 患者的长期临床结果中的作用尚未被研究。
在一项新的研究中,来自美国国家癌症研究所和弗吉尼亚大学等研究机构的研究人员在复发性或难治性CAYA B-ALL患者中进行了自体CD19.28ζ-CAR-T细胞的I期临床试验。他们评估了与疾病和治疗变量相关的反应和长期临床结果。相关研究结果近期发表在Journal of Clinical Oncology期刊上,论文标题为“Long-Term Follow-Up of CD19-CAR T-Cell Therapy in Children and Young Adults With B-ALL”。

11.Nature:AIM2炎小体在克隆性造血中加剧动脉粥样硬化
doi:10.1038/s41586-021-03341-5
在一项新的研究中,来自美国哥伦比亚大学的研究人员发现缓解炎症的疗法可能是预防常见的年龄相关性血液病患者患上心脏病的有效方法。他们确定了称为克隆性造血(clonal hematopoiesis)的血液病如何让动脉粥样硬化恶化,而且他们的发现表明一种先前在心血管疾病患者中广泛测试的抗炎药物,如果仅用于治疗克隆性造血的患者,可能有潜力。相关研究结果近期发表在Nature期刊上,论文标题为“The AIM2 inflammasome exacerbates atherosclerosis in clonal haematopoiesis”。
当四个特定基因中的一个基因发生突变时,通常会产生克隆性造血。在这项新的研究中,这些研究人员特别研究了JAK2,它赋予早发性冠状动脉疾病的风险最强。在动脉粥样硬化中,称为巨噬细胞的白细胞在斑块中积累,并随着斑块的生长而增殖。在对小鼠的研究中,这些研究人员发现,JAK2突变导致巨噬细胞发生了一些变化,增加了巨噬细胞的增殖以及动脉粥样硬化斑块中的炎症,并增强了动脉粥样硬化斑块的坏死核心。
这些研究人员还追踪了导致这些变化的分子机制,包括AIM2炎性体的活化增加,其中AIM2炎性体是一种诱导炎症的蛋白复合体。抑制AIM2炎性体的各种成分可以改善动脉粥样硬化斑块的稳定性,抑制这种炎性体的产物IL-1ß也是如此。虽然一种名为康纳单抗(canakinumab)的IL-1ß抑制剂在临床试验中减少了心血管事件,但该药物与较小的感染风险有关,并且尚未上市以减少心血管疾病。
12.Cell Stem Cell:新发现!核糖体装配对于造血干细胞的再生非常重要!
doi:10.1016/j.stem.2021.02.008
近日,一项刊登在国际杂志Cell Stem Cell上的研究报告中,来自费城儿童医院等机构的科学家们通过研究识别出了通过核糖体组装进行造血干细胞(HSC,hematopoietic stem cell)再生的关键基因,核糖体是细胞中的蛋白质制造工厂,其能将mRNA序列转化成为氨基酸序列;本文研究结果强调了合适的蛋白质装配对于干细胞再生的重要性,并识别出了潜在的靶点有望帮助开发治疗核糖体病变(ribosomopathies)及诱发骨髓衰竭的儿童障碍的新型疗法。
图片来源:CC0 Public Domain。
此外,研究人员还发现,在Hectd1缺失的造血干细胞中敲除ZNF622基因或能恢复大亚基和小亚基进行适当结合的能力,从而就会恢复蛋白质的合成和造血干细胞的产生。最后研究者Tong说道,相关研究结果不仅强调了蛋白质降解、核糖体装配以及干细胞产生之间的关系,而且还揭示了敲除ZNF622从而来恢复机体正常的骨髓功能的重要性,这对于儿童发育至关重要。后期研究人员还希望进一步研究将这种机制作为一种潜在的靶点来帮助开发治疗相关疾病的新型疗法。
13.Cell:新研究揭示动脉粥样硬化加速克隆性造血产生
doi:10.1016/j.cell.2021.01.049
在一项新的研究中,来自美国麻省总医院(MGH)和哈佛医学院的研究人员如今提出了一种不同的、额外的可能性:动脉粥样硬化导致克隆性造血。动脉粥样硬化患者遭受高脂血症和炎症,这两种症状会长期增强造血干细胞分裂率。他们证实这种增加的分裂会加速克隆性造血的产生。相关研究结果于2021年2月25日在线发表在Cell期刊上,论文标题为“Increased stem cell proliferation in atherosclerosis accelerates clonal hematopoiesis”。

图片来自Cell, 2021, doi:10.1016/j.cell.2021.01.049。
Naxerova表示,她的团队的发现对于克隆性造血患者来说可能是一个潜在的好消息:“毫无疑问,需要更多的研究来仔细剖析克隆性造血与心血管疾病之间的联系。但我们的结果表明,克隆性造血在某些情况下可能只是造血系统过度活跃的一个相对无害的信号,它本身并没有危险。”(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


