Nature:重大进展!揭示脱氧核酶切割RNA分子机制
来源:本站原创 2022-01-09 14:58
在一项新的研究中,来自德国杜塞尔多夫大学、波恩大学和尤利希研究中心的研究人员在原子分辨率下研究了DNAzyme如何实时地发挥作用。相关研究结果发表在2022年1月6日的Nature期刊上,论文标题为“Time-resolved structural analysis of an RNA-cleaving DNA catalyst”。
2022年1月9日讯/生物谷BIOON/---脱氧核酶(DNAzyme)是精确的生物催化剂。一些DNAzyme可以破坏不需要的RNA分子。然而,它们在医学上的应用仍然存在重大障碍。在一项新的研究中,来自德国杜塞尔多夫大学、波恩大学和尤利希研究中心的研究人员在原子分辨率下研究了DNAzyme如何实时地发挥作用。相关研究结果发表在2022年1月6日的Nature期刊上,论文标题为“Time-resolved structural analysis of an RNA-cleaving DNA catalyst”。
DNAzyme是由DNA和酶(enzyme)组成的词,是具有催化作用的DNA序列。它们包括一个由大约15个核苷酸组成的催化核心,两侧是位于催化核心的左右两边的短结合臂,每个结合臂大约有10个核苷酸。虽然催化核心的序列是固定的,但结合臂可以被修改,以便特异性匹配几乎任何RNA靶序列。
这项研究的目的是靶向病毒、癌症或受损神经细胞中不需要的RNA分子,可使用DNAzyme攻击并摧毁它们。这是通过与靶RNA分子上的核苷酸序列相匹配的结合序列实现的。DNAzyme精确地对接到匹配的位置,它的催化核心切割RNA分子,然后所产生的RNA片段在细胞中迅速降解。DNAzyme的结合臂可以快速和轻松地交换。
治疗的好处是显而易见的:不需要的RNA可以被精确地摧毁,而细胞中其他有用的RNA链则保持不受影响。在一些病毒中,如SARS-CoV2和埃博拉病毒,遗传物质被编码在一个RNA分子上。与健康细胞一样,癌细胞使用所谓的信使RNA(mRNA)编码蛋白。癌细胞中的mRNA序列往往与健康细胞略有不同,或以不同的数量存在,这意味着DNAzyme可以特异性地攻击癌细胞,而不影响其他细胞。
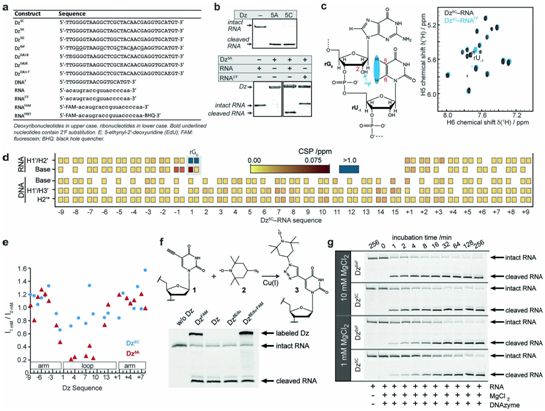
使用的构造体的性质和对修改的验证。图片来自Nature, 2022, doi:10.1038/s41586-021-04225-4。
论文通讯作者、杜塞尔多夫大学物理生物学研究所工作组组长Manuel Etzkorn博士说,“理论上听起来很出色,而且20年前就已经提出来了,不幸的是,在医学实践中并没有这样的效果。在试管中,DNAzyme非常有效地破坏RNA分子,但这在细胞中很少发生。必须有一个竞争过程来阻止DNAzyme的作用。然而,如果不从根本上了解它们的功能,就很难开发出能在细胞中完成任务的改进型DNAzyme变体。我们的新见解如今为这种僵局带来了新的动向。”
在这项新的研究中,这些作者试图了解该系统作为一个整体是如何动态运作的,在结合和切割过程中发生了哪些步骤,以及哪些辅助因子支持该反应。
这些作者利用高分辨率核磁共振(NMR)光谱,在原子分辨率下部分实时地观察了这些过程。这使他们能够描绘出DNAzyme结合和切割RNA时的三维原子排列。它的催化核心以一种高度有效的方式包裹着RNA链,在几个中间步骤中把它切割成两部分。切割后,DNAzyme释放出切割后的RNA片段,并可以在其他地方再次结合。
论文共同作者、杜塞尔多夫大学制药与药物化学主任Holger Gohlke博士补充说,“在综合建模的最佳意义上,我们能够在原子水平上提出一个合理的RNA切割机制,并提供关于切割位点的RNA碱基偏好的信息。”Gohlke实验室对DNAzyme/RNA复合物进行了分子动力学模拟.
论文第一作者、Etzkorn工作组博士研究员Jan Borggräfe解释了为什么DNAzyme在细胞中不能很好地工作:“我们确定,镁作为一种关键的辅助因子,在这种机制中发挥着多种重要作用,但它与DNA酶的结合相对较差,而且只是短暂的结合。细胞中还有其他对镁有更大亲和力的成分,可以说是把镁从DNAzyme中‘偷走’了。”
下一步是对细胞培养物和类器官进行结构调查。治疗应用的目标是通过有针对性的修改来改善DNAzyme的镁亲和力,以提高其在生物组织中的活性。
Etzkorn博士指出了另一个应用领域:“我们研究所的重点是研究神经退行性疾病,在这方面我们也看到了DNAzyme的良好潜力。在帕金森病的情况下,它们可能在某些情况下能够破坏驱动α-突触核蛋白产生的mRNA序列,其中α-突触核蛋白的大量产生会促进神经毒害过程。”DNAzyme还可能产生一类新的抗生素。
杜塞尔多夫大学物理生物学研究所主任Dieter Willbold教授博士补充说,“这项研究是结构生物学的基础研究如何为突破性的生物医学进展提供重要贡献的又一个例子。”(生物谷 Bioon.com)
参考资料:
Jan Borggräfe et al. Time-resolved structural analysis of an RNA-cleaving DNA catalyst. Nature, 2022, doi:10.1038/s41586-021-04225-4.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


