全球NASH药物!Ocaliva(OCA,奥贝胆酸)在美国进入优先审查,或将2020年一季度获批上市!
来源:本站原创 2019-12-10 09:27
2019年12月10日讯 /生物谷BIOON/ --Intercept Pharma是一家专注于开发和商业化新型疗法治疗进展性、非病毒性肝病的生物制药公司。近日,该公司宣布,评估Ocaliva(obeticholic acid,OCA,奥贝胆酸)治疗非酒精性脂肪性肝炎(NASH)引起的纤维化的III期REGENERATE研究中期分析的阳性结果已发表于《柳叶刀
2019年12月10日讯 /生物谷BIOON/ --Intercept Pharma是一家专注于开发和商业化新型疗法治疗进展性、非病毒性肝病的生物制药公司。近日,该公司宣布,评估Ocaliva(obeticholic acid,OCA,奥贝胆酸)治疗非酒精性脂肪性肝炎(NASH)引起的纤维化的III期REGENERATE研究中期分析的阳性结果已发表于《柳叶刀》(The Lancet)。值得一提的是,这是评估一种研究性药物治疗NASH关键性临床研究阳性结果的首次同行评议发表。
今年11月底,OCA治疗NASH所致纤维化的新药申请(NDA)获美国FDA受理并被授予了优先审查。FDA对那些有潜力治疗严重疾病的药物给予优先审查,如果批准,将在安全性或有效性方面提供重大进步。FDA已指定该NDA的处方药用户收费法(PDUFA)目标日期为2020年3月26日。
在美国,NASH预计最快在2020年成为肝移植的主要原因。如果获得批准,OCA将是第一个可用于治疗NASH所致肝纤维化患者的方法。值得一提的是,在NASH方面,OCA是唯一被FDA授予突破性药物资格(BTD)的研究性药物,同时是全球第一个进入、也是第一个成功完成III期临床的研究性药物。
REGENERATE研究在因NASH所致2阶段或3阶段肝纤维化患者中开展,评估了2种剂量OCA(10mg和25mg,每日一次)相对于安慰剂的疗效和安全性。
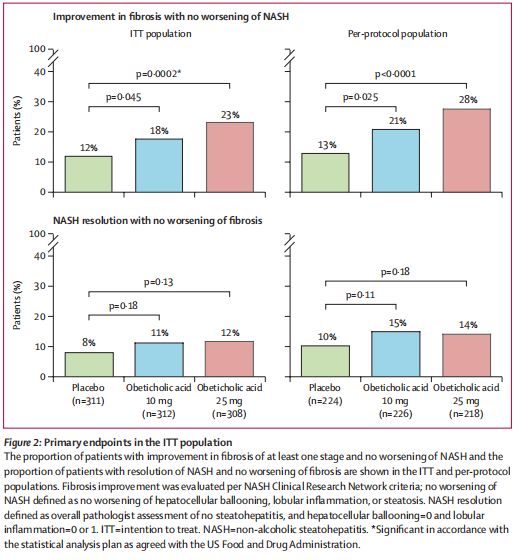
在主要疗效分析中,在预先计划的18个月中期分析时,与安慰剂相比,每日一次25mg剂量0CA达到了纤维化改善(≥1个阶段)并且NASH没有恶化的主要终点(p=0.0002)。此外,与安慰剂组相比,25mg剂量OCA治疗组有更高比例的患者达到NASH消除且肝脏纤维化没有恶化的主要终点。
该研究目前正在继续推进,将继续通过临床结果,以验证和描述临床效益。研究的18个月中期分析数据作为OCA治疗NASH所致纤维化的新药申请(NDA)的基础。如前所述,Intercept还计划在2019年第四季度向欧洲药品管理局(EMA)提交营销授权申请(MAA)。
美国伊诺瓦费尔法克斯医学院教授兼医学系主任、REGENERATE指导委员会主席、文章第一作者Zobair M. Younossi表示:“NASH领域第一个阳性III期研究结果代表了这一肝脏学领域的一个真正的分水岭。REGENERATE研究中OCA治疗18个月后观察到的抗纤维化作用特别有意义,因为纤维化是NASH患者肝衰竭和死亡的最重要的组织学预测因素。”
Ocaliva是一种法尼酯X受体(FXR)激动剂,FXR是一种表达于肝脏和小肠中的核受体,是胆汁酸、炎症、纤维化、代谢通路中的关键调节因子。在美国,Ocaliva于2016年5月获批上市,用于原发性胆汁性胆管炎(PBC)的治疗。目前,Ocaliva正被开发用于其他多种慢性肝脏疾病的治疗,包括NASH、原发性硬化性胆管炎、胆道闭锁等。
非酒精性脂肪性肝炎(NASH)是一种严重的进行性肝病,由肝脏脂肪过多堆积引起慢性炎症,导致进行性纤维化(瘢痕),可导致肝硬化、肝衰竭、肝脏癌症和死亡。晚期纤维化与NASH患者肝脏相关的发病率和死亡率显著升高相关。
根据《自然》杂志,在美国,NASH已成为继慢性丙型肝炎之后导致肝移植的第二大常见原因,预计在2020年将成为首要原因。目前,NASH市场规模已达到400亿美元。然而,尽管存在迫切的医疗需求,迄今为止还没有药物被批准用于治疗NASH。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


