白血病新型靶向药!PI3Kδ/γ双效抑制剂Copiktra欧盟即将获批,石药集团将2021年国内上市!
来源:本站原创 2021-03-29 17:42
在中国,石药集团Copiktra已获得国家药监局纳入优先审查,将于今年获批上市。

2021年03月29日/生物谷BIOON/--Secura Bio是一家综合性的美国生物制药公司,致力于为肿瘤患者提供创新疗法。近日,该公司靶向抗癌药Copiktra(duvelisib)在欧盟监管方面传来喜讯。欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议批准Copiktra,该药是一种口服磷酸肌醇-3激酶(PI3K)抑制剂,用于治疗:(1)先前接受过至少2种疗法的复发或难治性慢性淋巴细胞白血病( CLL)成人患者;(2)对至少2种先前的系统疗法治疗无效的难治性滤泡性淋巴瘤(FL)成人患者。
现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者通常会在2个月内做出最终审查决定。如果获批上市,Copiktra将以15mg和25mg硬胶囊提供给患者。
Copiktra是由Verastem Oncology公司开发的一款抗肿瘤药物。但在2020年8月,Verastem以3.11亿美元的价格将Copiktra的全球商业化权益出售给了Secura Bio公司。
2018年9月,石药集团与Verastem签署4500万美元协议,获得了在中国市场开发和商业化Copiktra的独家权利。根据石药集团在2021年3月15日发布的《2020年年度业绩报告》,Copiktra在国内的上市申请已获受理并获得了优先审评资格,预计2021年获批上市。
2019年7月,赛诺菲(Sanofi)与Verastem签订协议,获得了在俄罗斯、独联体、土耳其、中东、非洲开发和商业化Copiktra治疗所有肿瘤学适应症的独家权利。

Copiktra的活性药物成分为duvelisib(ATC代码:L01EM04),这是一种针对磷酸肌醇-3激酶(PI3K)的靶向口服抑制剂,能够同时抑制PI3K-δ和PI3K-γ的活性,这2种蛋白激酶帮助参与恶性B细胞系和原发性CLL肿瘤细胞的增殖和存活,参与恶性B细胞肿瘤微环境中的免疫途径。
在美国,Copiktra是FDA批准的首个PI3K-δ和PI3K-γ双效抑制剂,该药于2018年9月获批,适应症为;(1)用于治疗既往已接受至少2种疗法的复发或难治性慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(R/R CLL/SLL)成人患者;(2)用于治疗既往已接受至少2种疗法的复发或难治性滤泡性淋巴瘤(FL)成人患者。需要指出的是,Copiktra的美国药品标签中含有一则黑框警告,提示致命和严重的毒性作用,包括感染、腹泻或结肠炎、皮肤反应和肺炎。
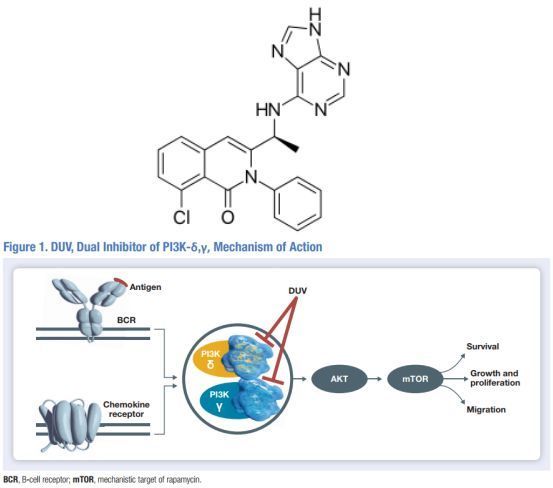
Copiktra活性药物成分duvelisib分子结构式(上)及作用机制(下)
根据CHMP的审查意见,Copiktra的治疗益处包括:
——Study 1:一项随机、多中心、开放标签临床试验(NCT02004522)在已接受过至少2种疗法的复发或难治性CLL成人患者中开展,数据显示,与诺华白血病药物Arzerra(ofatumumab,奥法木单抗,一种CD20靶向单抗)相比相比,Copiktra(25mg BID,每日2次25mg)显著延长了疾病无进展生存期(中位PFS:16.4个月 vs 9.1个月)、将疾病进展或死亡风险显著降低60%(HR=0.40)、显著提高了客观缓解率(ORR:74% vs 39%;ORR差异=39%)。
——Study 2:一项单臂、多中心临床试验(NCT01882803)在已接受过至少2种疗法(包括:利妥昔单抗和化疗/放射免疫疗法)的难治性FL成人患者中开展,数据显示,Copiktra(25mg BID,每日2次25mg)治疗诱导了具有临床意义的肿瘤缓解(ORR=35%),分别有43、17%的患者缓解持续时间(DOR)≥6个月、12个月。(生物谷Bioon.com)
原文出处:欧洲药品管理局官网、Copiktra美国处方信息、石药集团(CSPC)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


