第4款阿达木单抗生物仿制药!三星Bioepis/默沙东Hadlima获美国FDA批准
来源:本站原创 2019-07-24 16:06
2019年07月24日/生物谷BIOON/--韩国生物制药公司三星Bioepis近日宣布,美国食品和药物管理局(FDA)已批准Hadlima(adalimumab-bwwd,阿达木单抗),该药是艾伯维旗舰产品修美乐(Humira,通用名:adalimumab,阿达木单抗)的生物仿制药,用于治疗多种自身免疫性疾病,包括:类风湿性关节炎(RA)、幼年特发性关节炎(JIA)、银屑病关节炎(PsA)、强直

2019年07月24日/生物谷BIOON/--韩国生物制药公司三星Bioepis近日宣布,美国食品和药物管理局(FDA)已批准Hadlima(adalimumab-bwwd,阿达木单抗),该药是艾伯维旗舰产品修美乐(Humira,通用名:adalimumab,阿达木单抗)的生物仿制药,用于治疗多种自身免疫性疾病,包括:类风湿性关节炎(RA)、幼年特发性关节炎(JIA)、银屑病关节炎(PsA)、强直性脊柱炎(AS)、成人克罗恩病(CD)、溃疡性结肠炎(UC)、斑块型银屑病。
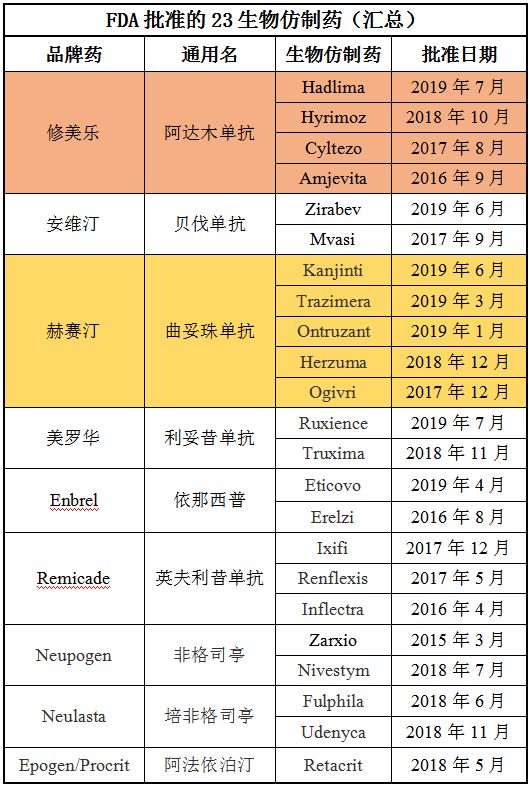
Hadlima是三星Bioepis公司在美国批准的第三款抗TNF生物仿制药,同时也是该公司在美国批准的第4款生物仿制药。其他3款分别为Renflexis(infliximab-abda,英夫利昔单抗,2017年4月获批)、Ontruzant(trastuzumab-attb,曲妥珠单抗,2019年1月获批)、Eticovo(etanercept-ykro,依那西普,2019年4月获批)。
Hadlima由三星Bioepis开发,并将在美国由合作伙伴默沙东进行商业化。根据与艾伯维签署的许可协议,Hadlima预计将于2023年6月30日后在美国上市。
除了美国以外,三星Bioepis公司的阿达木单抗生物仿制药已获准在30多个国家进行销售,其中包括28个欧盟成员国、加拿大、澳大利亚和韩国。
FDA批准Hadlima,是基于一项随机、双盲52周III期研究的数据。该研究共入组了544例接受甲氨蝶呤(MTX)病情控制不佳的中度至重度类风湿性关节炎(RA)患者。研究中,患者随机分配接受Hadlima或阿达木单抗参考产品(ADL)治疗。
数据显示,在第24周,Hadlima治疗组的ACR20应答率为72.4%,ADL组为72.2%。24周治疗期间,Hadlima的安全性与ADL具有可比性。在第24周,254例接受ADL的患者以1:1的比例重新随机分组,继续进行ADL或过渡到Hadlima,254例接受Hadlima治疗的患者继续接受Hadlima治疗。截至第52周,这三个治疗组的疗效、安全性和免疫原性仍具有可比性。患者接受2种药物交替治疗没有出现治疗引发的问题或临床相关的免疫原性。(生物谷Bioon.com)
原文出处:三星Bioepis公司网站
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


