精神病学新药!激越急性治疗十年重大进展:BXCL501(右美托咪定舌下膜剂) 3期临床疗效显著!
来源:本站原创 2022-02-24 00:25
BXCL501用于精神分裂症和双相情感障碍相关激越的急性治疗。

激越(图片来源:seekingalpha.com)
2022年02月23日讯 /生物谷BIOON/ --BioXcel Therapeutics是一家临床阶段的生物制药公司,致力于利用人工智能方法开发神经科学和免疫肿瘤学领域的变革性药物。近日,该公司宣布,评估BXCL501(右美托咪定舌下膜剂)用于急性治疗双相情感障碍相关激越(agitation)的关键3期SERENITY II试验的结果,已在线发表于《美国医学会杂志》(JAMA)。详见:Effect of Sublingual Dexmedetomidine vs Placebo on Acute Agitation Associated With Bipolar Disorder: A Randomized Clinical Trial。
数据显示,与安慰剂相比,BXCL501在主要和关键次要疗效指标方面表现出具有统计学意义和临床意义的改善。主要终点方面,通过治疗后2小时阳性和阴性症状量表-激越成分(PEC)总分相对基线的变化来衡量,与安慰剂相比,2种剂量BXCL501(120mcg,180mcg)均显著减少了激越。次要终点方面,与安慰剂相比,2种剂量BXCL501在启动治疗后20分钟就显示出统计学显著的治疗效果。该研究中,180mcg、120mcg、安慰剂的不良事件发生率分别为35.7%、34.9%、17.5%。
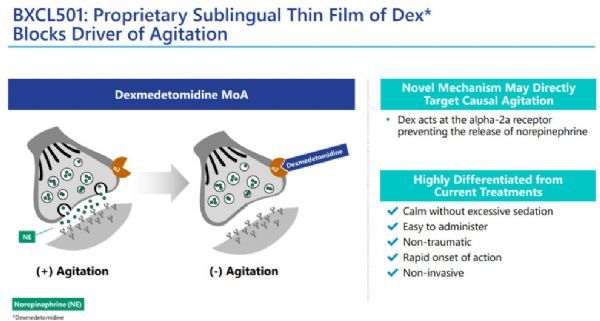
BXCL501是一种在研的、专有的、经口溶解的右美托咪定(dexmedetomidine)薄膜制剂;右美托咪定是一种选择性α2a受体激动剂,临床上作为静脉制剂,用于治疗与神经精神疾病相关的激越和阿片类药物戒断症状。BXCL501潜在地靶向一种因果性的激越机制,在多种神经精神疾病的多项临床研究中均观察到了抗激越作用,包括精神分裂症相关激越(SERENITY I)、双相情感障碍相关激越(SERENITY II)、痴呆症相关激越(TRANQUILITY)。
目前,BXCL501的上市申请(NDA)正在接受美国FDA的审查:用于急性治疗与精神分裂症及双相情感障碍I型和II型相关的激越(agitation)。2021年12月,FDA将《处方药申报者付费法案(PDUFA)》决议目标日期延长3个月,至2022年4月5日。如果获得批准,BXCL501将代表近十年来在精神分裂症和双相情感障碍相关激越急性治疗方面的第一个重大进展。
此前,美国FDA已授予BXCL501急性治疗痴呆症相关激越的突破性药物资格(BTD),以及急性治疗与精神分裂症、双相情感障碍和痴呆症相关激越的快速通道资格(FTD)。
BXCL501作用机制(点击图片,查看大图)
激越(agitation)是一种常见且难以控制的症状,与多种神经精神疾病相关,包括精神分裂症和双相情感障碍I型和II型。目前,激越仍然是一个日益增长的医疗负担。据估计,仅这2种疾病在美国就有大约900万成人患者,每年有300多万人经历激越。平均来说,患有这些疾病的患者每年会经历十几次发作,大多数需要药物治疗。
早期识别和及时干预,以减轻激越是必不可少的,以避免症状升级和侵略性的出现。专家一致的最佳实践指南建议,激越应结合行为镇静技术、言语缓和及患者自愿接受的药物治疗,而不受强迫,药理学的目标是“镇静而不过度镇静”。一种能迅速和持续缓解症状的非侵入性疗法可能有助于避免使用昂贵和创伤性的强制手段,如身体约束和隔离,这可能导致入院和延长住院时间。
BXCL501 NDA基于2项随机、双盲、安慰剂对照、平行组3期研究(SERENITY I和SERENITY II)的数据支持。这2项研究分别评估了BXCL501用于精神分裂症及双相情感障碍I型和II型相关激越的急性治疗。在这2项研究中,BXCL501耐受性良好,在120mcg和180mcg剂量下均达到主要和次要终点,表明在多个激越量表中,与安慰剂相比,较基线水平有统计学显著、快速和持久的改善。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->