免疫调节疫苗!美国FDA授予IO102/IO103突破性药物资格:联合O药一线治疗黑色素瘤总缓解率79%
来源:本站原创 2020-12-16 18:58
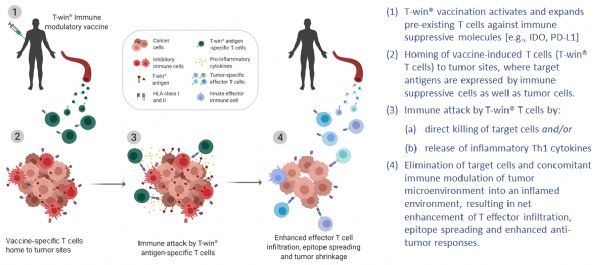
IO102和IO103是一类首创免疫调节疫苗,可激活IDO和PD-L1特异性T细胞。

2020年12月16日讯 /生物谷BIOON/ --IO Biotech是一家临床阶段的生物技术公司,致力于开发治疗癌症的突破性免疫疗法。该公司首创免疫调节抗癌疗法管线,由独特的技术平台T-win®开发,能够激活免疫抑制分子特异性T细胞。
BTD是FDA在2012年创建的一个新药评审通道,旨在加快开发及审查用于治疗严重或威及生命的疾病、并且有初步临床证据表明该药与现有治疗药物相比在一个或多个具有临床意义的终点方面有显著改善的新药。获得BTD的药物,在研发时能得到包括FDA高层官员在内的更加密切的指导,保障在最短时间内为患者提供新的治疗选择。
IO102和IO103是IO Biotech领先的免疫肿瘤学候选产品。这2种化合物均基于IO Biotech的专利T-win®技术平台,该平台能够识别具有双重作用机制的化合物,即靶向并直接杀死免疫抑制细胞和肿瘤细胞,同时间接激活其他T效应器,从而在不增加额外安全性的情况下产生强大的抗肿瘤反应。具体而言,IO102和IO103是一类首创的(first-in-class)免疫调节疫苗,IO102含有一段IDO(吲哚胺2,3-双加氧酶)衍生肽序列,IO103含有一段PD-L1衍生肽序列,旨在激活IDO和PD-L1特异性人类调节性T细胞。
T-win免疫调节疫苗-作用机制(图片来源:IO Biotech)-点击图片查看大图
此次BTD资格认定,基于MM1636 1/2期临床试验的数据。该试验在30例转移性黑色素瘤患者中评估了IO102、IO103和抗PD-1疗法。2期部分中,患者接受了多抗原疫苗IO102-IO103联合抗PD-1单抗Opdivo(欧狄沃,通用名:nivolumab,纳武利尤单抗)作为一线治疗。研究中,IO102-IO103每2周给药一次直至12周,之后每4周一次直至1年。该试验的目的是评估安全性、血液和活检的免疫反应以及疗效。
根据最近在欧洲医学肿瘤学会(ESMO)2020虚拟大会上发表的最新摘要数据,IO102疫苗+IO103疫苗+Opdivo组合方案被证明是安全的,早期疗效数据令人鼓舞:79%的患者病情缓解(总缓解率[ORR]=79%),45%的患者病情完全缓解或肿瘤完全消失(完全缓解率[CR]=45%)。在外周血单个核细胞(PBMC)和肿瘤部位均发现了疫苗特异性T细胞。
全球范围内,每年新确诊约29万例皮肤黑色素瘤(最具侵袭性的皮肤癌)、死亡超过6万例。皮肤黑色素瘤的发病率正在增加,晚期黑色素瘤(不可切除或转移)如果不治疗将有致命后果。IV期黑色素瘤患者(未经治疗或使用BRAF抑制剂和MEK抑制剂治疗)的中位总生存期(OS)在22-25个月之间,3-5年生存率约为40%。因此,对不显著增加毒性的情况下提高抗PD-1疗效的改良联合疗法存在着显著未满足的医疗需求。
IO Biotech首席执行官兼创始人Mai Britt Zocca博士表示:“一项突破性的指定是一项快速计划,在该计划中,FDA将与IO生物技术公司密切合作,为后续开发“编码人类PD-L1(9-27)和(IO102)的合成肽疫苗(IO103),针对IDO、吲哚胺2,3-双加氧酶和抗PD-1”,为治疗不可切除/转移性黑色素瘤提供指导,“包括提供建议,以有效且可能加快的方式提供支持药物批准所需的证据,”说这是IO Biotech临床项目的一项重要成就,我们致力于尽快将这一成果带给患者。”
原文出处:The Food and Drug Administration (FDA) grants IO Biotech breakthrough therapy designation for IO102 and IO103 in combination with anti-PD-1 in unresectable/ metastatic melanoma
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->