胆汁淤积症突破性药物!强效回肠胆汁酸转运体抑制剂odevixibat在美国和欧盟申请上市!
来源:本站原创 2020-12-11 20:52
odevixibat有潜力成为第一个治疗进行性家族性肝内胆汁淤积症(PFIC)的药物。

2020年12月11日讯 /生物谷BIOON/ --Albireo Pharma是一家开发新型胆汁酸调节剂的临床阶段罕见肝病公司。近日,该公司宣布,已向美国食品和药物管理局(FDA)提交了一份新药申请(NDA)、向欧洲药品管理局(EMA)提交了一份营销授权申请(MAA),寻求批准odevixibat用于治疗进行性家族性肝内胆汁淤积症(PFIC)。PFIC是一种毁灭性的疾病,许多患者的唯一选择是肝移植或其他侵入性手术。
EMA将通过加速审批程序对odevixibat进行审查。随着FDA和EMA监管申请文件提交完成,odevixibat有潜力成为美国和欧洲第一个被批准用于PFIC的治疗药物。此前,EMA已授予odevixibat治疗PFIC的孤儿药资格、优先药物资格(PRIME),FDA已授予odevixibat治疗PFIC的快速通道资格(FTC)、罕见儿科疾病资格(RPDD)和孤儿药资格(ODD)。
odevixibat是一种首创、强效选择性、非系统性、回肠胆汁酸转运体(IBAT)抑制剂,具有最小的全身暴露并在肠道内局部发挥作用。目前,该药正被开发用于罕见儿童胆汁淤积性肝病的治疗,包括PFIC、胆道闭锁、Alagille综合征;其中,PFIC是首个目标适应症。
最近在AASLD会议上公布的数据,证实odevixibat治疗可为PFIC患者提供持久缓解。全球3期PEDFIC-1临床研究是在PFIC中开展的有史以来最大规模的研究。结果显示,研究达到了美国和欧盟监管要求的主要终点:与安慰剂相比,odevixibat显著降低了胆汁酸反应(SBA,p=0.003)、显著改善了皮肤瘙痒(p=0.004),腹泻率仅为个位数。此外,来自PEDFIC-2(开放标签3期扩展研究)的长期数据显示,在治疗长达48周的患者中,SBA持续和持久地减少、瘙痒评估得到改善、肝脏和生长功能指标令人鼓舞。在这2项研究中,odevixibat的耐受性良好,治疗引起的不良事件(TEAE)大多为轻度或中度。
odevixibat化学结构式(图片来源:medkoo.com)
总的来说,这些研究再次证实了odevixibat有潜力成为第一个被批准用于治疗PFIC的药物。PFIC是一种毁灭性的疾病,目前采用包括肝移植在内的手术治疗。odevixibat是一种安全有效的治疗药物,有潜力为PFIC患者及其家属带来真正意义上的改变。在获得监管批准后,Albireo公司计划在2021年下半年将odevixibat推向市场。
Albireo公司总裁兼首席执行官Ron Cooper表示:“我们在创纪录的时间内完成了向美国和欧盟监管机构提交上市申请文件,这表明Albireo团队致力于尽快为不同类型的PFIC患者提供治疗方案。有了随机、安慰剂对照PEDFIC临床项目数据、美国和欧盟的孤儿资格认定、欧盟PRIME计划的加速评估和准入以及美国的快速通道资格认定,我们有望在2021年下半年获得批准、并将在全球范围内首次为PFIC患者带来第一种治疗药物。”
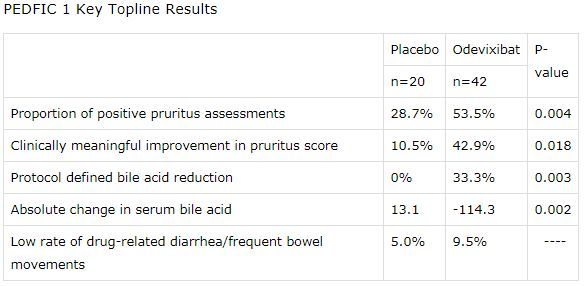
PEDFIC-1是一项随机、双盲、安慰剂对照、全球多中心3期研究,在62例年龄6个月至15.9岁的PFIC1或PFIC2患者中开展。研究中,患者随机分配,接受2种口服剂量odevixibat的商业化制剂(40μg/kg/天,120μg/kg/天)或安慰剂,每日一次治疗24周。odevixibat治疗组患者接受每日一次口服胶囊或喷剂,这2类制剂不需要冷藏。
数据显示,在主要分析中,研究达到了符合美国监管的主要终点:odevixibat治疗组瘙痒评估阳性率为53.5%、安慰剂组为28.7%(p=0.004)。次要终点方面,odevixibat治疗组有42.9%的患者瘙痒评分有临床意义改善(定义为:在0-4分量表上,第24周瘙痒评分从基线水平下降≥1.0分)、安慰剂组为10.5%(p=0.018)。
此外,该研究也达到了符合欧盟监管的主要终点:odevixibat治疗组有33.3%的患者血清胆汁酸(sBA)降低70%或达到70μmol/L水平,安慰剂组没有患者达到这一目标(p=0.003)。次要终点方面,odevixibat治疗组胆汁酸平均降低114.3μmol/L、安慰剂组增加13.1μmol/L(p=0.002)。
2种剂量odevixibat在每个终点方面均有统计学意义。研究中,odevixibat的耐受性良好。不良事件发生率与安慰剂相似。研究过程中,没有发与药物相关的严重不良事件(SAE)。腹泻/频繁排便是最常见的与治疗相关的胃肠道不良事件,在odevixibat治疗的患者中发生率为9.5%,安慰剂组为5.0%。(生物谷Bioon.com)
原文出处:Albireo submits U.S. and European applications for odevixibat in liver disease
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


