2021盘点|新冠特效药及疫苗获批、全新数据汇总
来源:生物谷原创 2021-01-02 14:14
2021转眼即逝,我们希望新冠病毒也能够随着时光早日消逝,2021年科学家们努力研发疫苗和特效药。盘点与新冠病毒交手的一年,小编就对本年度科学家们在该新冠研究领域取得的重磅级研究成果进行整理,分享给大家!
2021转眼即逝,我们希望新冠病毒也能够随着时光早日消逝,2021科学家们努力研发疫苗和特效药,盘点与新冠病毒交手的一年,小编就对本年度科学家们在该新冠研究领域取得的重磅级研究成果进行整理,分享给大家!
一、特效药物
【1】抗病毒新冠药物 Molnupiravir
2021年11月4日,默沙东/Ridgeback的小分子药物 Molnupiravir 获得英国药品和保健产品监管局(MHRA)批准上市,用于治疗重症和住院风险较高的轻至中度COVID-19成人患者。Molnupiravir成为全球首个获批用于治疗成人轻度至中度COVID-19的口服抗新冠病毒药物。
Molnupiravir 最早是为治疗流感开发的,作用机制是让病毒在复制RNA时出错,产生抑制复制的突变。最近的中期3期临床试验结果表明,Molnupiravir 降低了 COVID-19 患者住院和死亡风险,并且对不同的新冠突变株同样有效。
小分子药物在价格和生产上更有优势,缩短合成流程、提高产量,能够进一步降低其成本,有助于药物的快速普及。默沙东公司的研究人员在通过生物催化级联反应实现了一种新型 Molnupiravir 合成路线,与最初的合成路线相比,新型合成路线缩短了70%,总产率提高了7倍。该研究以题为“Engineered Ribosyl-1-Kinase Enables Concise Synthesis of Molnupiravir, an Antiviral for COVID-19” 发表在ACS Central Science 期刊。
https://doi.org/10.1021/acscentsci.1c00608
【2】清华大学发布抗新冠病毒特效药物安巴韦单抗和罗米司韦单抗联合疗法研发成果。
12月8日,我国首个抗新冠病毒特效药——安巴韦单抗/罗米司韦单抗联合疗法特效药获得中国药监局的上市批准,由清华大学医学院教授张林琦领衔研发。这标志着中国拥有首个全自主研发并经过严格随机、双盲、安慰剂对照研究证明有效的抗新冠病毒特效药。

新冠单克隆中和抗体安巴韦单抗/罗米司韦单抗联合疗法用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12-17岁,体重≥40 公斤)新型冠状病毒感染(COVID-19)患者。其中青少年(12-17岁,体重≥40公斤)适应症人群为附条件批准。
2021年12月3日,在严格的对比检测后,美国国立卫生研究院(NIH)公布了对安巴韦单抗/罗米司韦单抗联合疗法新冠抗体特效药的全部临床数据。在第三期临床试验中,与安慰剂相比,安巴韦单抗/罗米司韦单抗联合疗法能够降低高风险新冠门诊患者住院和死亡风险80%。同时,抗体在人体内可存留9至12个月的时间,对预防感染也有一定作用。特效药与新冠疫苗形成了很好的互补关系,在预防和治疗双层面均发挥作用。
【3】辉瑞公布口服抗新冠疗法(PF-07321332+利托那韦)最新数据。
https://www.businesswire.com/news/home/20211214005548/en/
https://www.statnews.com/2021/12/14/pfizers-covid-pill-remains-89-effective-in-final-analysis-company-says/
2021.12.15日,辉瑞(Pfizer)公司公布了其口服抗新冠病毒在研疗法Paxlovid的最新临床试验结果。在治疗有高风险发展为重症的COVID-19患者的2/3期临床试验中, Paxlovid能够降低患者住院或死亡风险接近90%。另一项2/3期临床试验结果显示,在发展为重症风险较低的人群中,Paxlovid也能将患者住院或死亡风险降低70%。此外,在体外实验显示,Paxlovid具有对包括Omicron在内的新冠病毒变种仍然保持强力抗病毒活性的潜力。
Paxlovid由新冠病毒3CL蛋白酶抑制剂nirmatrelvir(PF-07321332)和抗病毒疗法利托那韦(ritonavir)组成。Nirmatrelvir通过阻断新冠病毒3CL蛋白酶的活性,让病毒的后续RNA复制过程无法进行。低剂量的利托那韦能帮助降低nirmatrelvir的代谢或降解,让它在身体里保持活性更长时间,帮助抗击病毒。
【4】清肺排毒汤
2020年2月6日,国家中医药管理局发布:中医药有效方剂筛选取得巨大进展,清肺排毒汤有效率高达90%以上,轻中重症都有效,推荐全国使用。清肺排毒汤治疗后,轻症直接治愈,几乎没有一例转化为重症、危重症;重症、危重症治愈率大大提升,各种症状好转非常明显;而且合理使用后,它还有群体预防效果。目前已经纳入第七版诊疗方案,成为一个通用方剂。

美国资本巨头制药商利用中国的新冠特效药“清肺排毒汤”,通过实验室手段,提取成分,研制提纯,制成美国版“清肺排毒汤”(英文名:Lung Cleaner)

二、新冠疫苗
【1】mRNA疫苗
mRNA是把遗传信息从DNA传递到蛋白质的信使,编码抗原蛋白的mRNA被注射进人体后,能够在体内合成抗原蛋白(“刺突Spike蛋白”),从而引起人体免疫反应对抗病原体感染。
mRNA的体外合成技术已经成熟,可用T3、T7或者SP6 RNA聚合酶和线性DNA进行mRNA的合成。再经过头尾修饰、纯化、递送到细胞内。裸露的mRNA稳定性低、体内半衰期短,易被清除,使用脂质体包封后能提升稳定性、延长体内循环。其中Moderna和CureVac的新冠mRNA疫苗使用的都是LNP递送系统,但由于LNP强大的专利保护,让新的具有高递送效率的递送系统成为研究热点。目前全球领先的三大mRNA疫苗企业分别为:Moderna、BioNTech、CureVac。
mRNA疫苗与传统疫苗技术不同的是,可以促使人体直接产生病毒蛋白,mRNA疫苗能够呈现更多的抗原,同时能更持久地激活巩固特异性免疫。因此显示出常规疫苗不能体现的安全性、有效性、生产便捷性的独特优势,但是mRNA疫苗创新程度较高,工艺复杂,对于质量和安全性的要求也较高。
2020年11月18日,辉瑞发布了BNT162b2的III期临床试验结果,结果显示疫苗整体保护率高达95%。2021年3月31日,Moderna发布了mRNA-1273的III期临床试验结果,结果显示疫苗整体保护率也达到94.1%,与BNT162b2的数据非常接近。同时,mRNA疫苗在65岁及以上的老年群体中,仍能高效地激发免疫反应,保护率稳定在高水平。 NEJM 发表了一项重要研究,分析了两个 mRNA 疫苗在真实世界研究中的效果。结果提示mRNA 疫苗接种,不仅有效保护接种者免遭病毒感染,即便出现突破性感染,其传播病毒风险也会大幅降低,症状的严重程度以及持续时间同样明显优于那些没接种疫苗的人。mRNA 疫苗不仅保护接种者,也有效降低了病毒在人群之间的传播。(https://pubmed.ncbi.nlm.nih.gov/34192428/)
国内首个获批开展临床试验的mRNA疫苗是由军事科学院军事医学研究院与地方企业共同研究,开发形成的新型冠状病毒mRNA候选疫苗(ARCoV)已于2020年6月19日正式通过国家药品监督管理局临床试验批准。该疫苗具有良好的热稳定性,可在室温下保存一周以上,这对疫苗的运输极为重要,因此更有前途。该新冠mRNA疫苗已经按照临床试验要求完成了多批次生产,将于近期在树兰(杭州)医院正式启动I期临床试验。(https://pubmed.ncbi.nlm.nih.gov/32795413/)
mRNA疫苗同时展现出极为优异的保护率,提示mRNA疫苗技术能够非常高效得激活免疫系统。但是mRNA疫苗运用了全新的技术,目前的安全数据只反映了接种后短期内可能发生的不良反应,是否会对人体造成长期的影响还需要时间进行长期的观察。从理论分析,mRNA疫苗通过使部分人体细胞表达外源抗原来激活免疫,除了抗原本身会引起免疫反应,这部分表达抗原的自体细胞可能也会引起较强烈的免疫反应。
【2】灭活疫苗
传统疫苗激活特异性免疫的方式是直接将抗原蛋白注射进入人体,引起免疫反应;传统灭活疫苗的抗原呈递数量是一定的,即最终到达体内引起免疫反应的抗原数量只能够小于或等于疫苗中含有的抗原数量。同时,灭活疫苗呈递抗原的过程是一次性的,注射时疫苗呈递的抗原即为所有抗原,这些抗原的降解时长即为持续激活免疫的时长,此后不会有新增抗原。
国药集团及北京生物研究所、武汉生物研究所共同研发的WIV04和HB02是2款最先上市的传统灭活疫苗。2021年5月26日,JAMA发布了国药集团2款灭活新冠疫苗的临床III期结果。临床结果展现了不错的保护率,整体保护率均在70%以上,远远超出了世界卫生组织50%的要求。
接种WIV04 的12743人中,出现26例新冠感染;接种HB02的12726人中,出现21例新冠感染;安慰剂组共12737人,出现95例新冠感染。由此可计算得到WIV04的保护率为72.8%(95%CI:58.1-82.4),HB02的保护率为78.1%(95%CI:64.8-86.3)。但是与2款mRNA疫苗>90%的保护率相比略逊一筹。但是灭活疫苗因其成熟的技术和研发生产经验,不良反应发生频率较低,反应程度也较为温和。
2021年7月16日,经国务院联防联控机制有关部门组织论证,国药集团中国生物北京生物制品研究所新冠病毒灭活疫苗获批在3-17岁人群中紧急使用。目前国药集团中国生物新冠疫苗3-17岁年龄组已经在河南完成I/II期临床试验。3-17岁人群免后中和抗体阳转率为100%,中和抗体GMT和阳转率与成人组相比无显著性差异,接种后安全性良好。不良反应主要为发热和接种部位疼痛,严重程度以1级为主。未见严重不良反应,不良反应发生率随接种剂次增加而逐渐降低。
【3】腺病毒疫苗
2020年3 月 17 日,官方重磅宣布,军事科学院军事医学研究院陈薇院士领衔的科研团队,成功研制出重组新冠疫苗,并于 3 月 16 日获批展开临床试验。重组新型冠状病毒疫苗(腺病毒载体)(Ad5-nCoV)是由中国人民解放军军事科学院军事医学研究院陈薇院士团队及康希诺生物联合研发的新冠疫苗 ,是一种以人复制缺陷腺病毒为载体的重组新型冠状病毒疫苗 。Ad5-nCoV是中国首个针对COVID-19的新型冠状病毒疫苗。
2020年7月20日,《柳叶刀》杂志上发表的一项研究报告称,在2期研究中进行一次免疫后,Ad5载体的5×1010病毒颗粒的COVID-19疫苗是安全的,并且在大多数接受者中引起了明显的免疫反应。这一一期临床试验于武汉中南医院进行,分为肌肉注射、雾化吸入和两者同时接种等多个组别进行。试验发现,首次免疫接种后7 天内肌肉注射组(包含混合免疫组)(49/78,63%)比雾化吸入组(13/52,25%)发生更多的不良事件,雾化吸入组没有发生疫苗相关严重不良反应,显示出良好的耐受性和安全性。(https://pubmed.ncbi.nlm.nih.gov/34324836/)
除南非株(贝塔)略有下降外,康希诺疫苗等腺病毒载体疫苗对9株不同病毒的真病毒中和抗体效价相近,其中对印度株(德尔塔)假病毒中和作用较英国株(D614G)下降约0.9倍至1.4倍。灭活疫苗对德尔塔中和作用较D614G下降约1.4倍至2.3倍。
接种腺病毒载体新冠疫苗后出现的一种罕见但严重的不良反应是,疫苗诱发免疫血栓性血小板减少症(VITT),会导致血小板计数偏低(血小板减少症)以及动脉或静脉出现血液凝块。
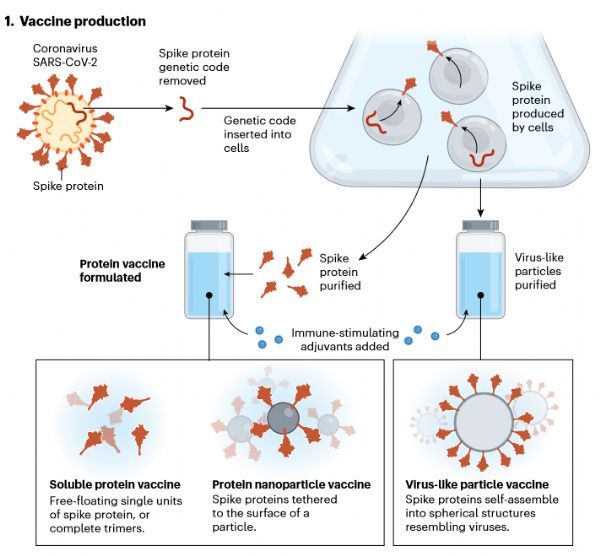
【4】蛋白质疫苗
蛋白质疫苗在预防肝炎、带状疱疹和其他病毒感染方面已经应用了几十年。与使用mRNA和病毒载体新技术的新冠疫苗不同,为了诱导保护性免疫反应,蛋白质疫苗将蛋白质联同刺激免疫产生的佐剂直接输送到人体细胞内。新冠蛋白质疫苗的设计如下图所示;
(https://pubmed.ncbi.nlm.nih.gov/34750543/)
11月1日,印度尼西亚首次为Novavax的疫苗给予了紧急授权,该疫苗也已向澳大利亚、加拿大、英国、欧盟等地的政府机构提交了监管备案。生物科技公司Novavax准备在今年底前,向美国药品监管机构提交该公司备受期待的蛋白质疫苗申请。亚洲的两家疫苗厂商,中国成都的三叶草生物和印度海得拉巴的Biological E公司,也将在未来几周和几个月内向国内的监管机构提交类似申请。
Novavax的疫苗在年初完成的一个3万人的研究中,对COVID-19有症状感染的保护率超过了90%;成都三叶草报告显示其对各个轻重程度的COVID-19有症状感染的保护率为67%(包括Delta和Mu变异株)。这两种疫苗与mRNA疫苗诱导的抗体水平不相上下,而mRNA疫苗是当前在新冠疫情中效力最高的疫苗。
尽管蛋白质疫苗尚未登上预防COVID-19的大舞台,但目前处于后期的临床试验数据显示,相比其他新冠疫苗,蛋白质疫苗表现出较强的保护力和更少的不良反应。而且会成为最便宜且容易规模化的疫苗。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。