Nature:重大进展!28天内在体外将造血干细胞的数量扩大900倍,让无需接受调理治疗的造血干细胞移植成为可能
来源:本站原创 2019-06-02 17:02
2019年6月2日讯/生物谷BIOON/---在一项新的研究中,来自美国斯坦福大学和日本东京大学等研究机构的研究人员可能破解了在没有放疗和化疗的情况下进行干细胞移植和基因治疗的密码。几十年来,科学家们在实验室中培养大量造血干细胞的尝试一直受阻。这些罕见的骨髓细胞单独负责产生血液和免疫系统中的所有细胞。培养这些细胞的困难严重阻碍了许多研究工作,包括那些让某些癌症或血液疾病患者更容易和更安全地接受干细
2019年6月2日讯/生物谷BIOON/---在一项新的研究中,来自美国斯坦福大学和日本东京大学等研究机构的研究人员可能破解了在没有放疗和化疗的情况下进行干细胞移植和基因治疗的密码。
几十年来,科学家们在实验室中培养大量造血干细胞的尝试一直受阻。这些罕见的骨髓细胞单独负责产生血液和免疫系统中的所有细胞。培养这些细胞的困难严重阻碍了许多研究工作,包括那些让某些癌症或血液疾病患者更容易和更安全地接受干细胞移植或基因治疗的研究工作。
如今,这些研究人员破解了这些密码。通过调整培养这些细胞的营养液中的组分、用于支持它们生长的专门分子和培养它们所需的物理条件,他们首次证实诱导来自小鼠的造血干细胞在短短28天的时间内自我更新数百甚至数千次是可能的。
论文共同通讯作者、斯坦福大学遗传学教授Hiromitsu Nakauchi博士说道,“这是我作为干细胞研究员的人生目标之一。50年来,世界各地实验室的科学家们一直在寻找大量培养这些细胞的方法。如今,我们鉴定出一系列条件,足以让这些细胞的数量在短短一个月内扩大900倍。我们认为这种方法可能引发在人体中开展造血干细胞移植和基因治疗的变革。”
特别地,这些研究人员证实在不首先消除受者自身干细胞群体的情况下,成功地将大量体外培养的造血干细胞移植到小鼠体内是有可能的。如果这种技术也适用于人类,那么它可能在移植前让数千名患有血液疾病或免疫疾病的患者免受严格的放疗或化疗方案。它还可能允许临床医生利用患者自己的经过基因校正的干细胞进行基因治疗。
相关研究结果于2019年5月29日在线发表在Nature期刊上,论文标题为“Long-term ex vivo haematopoietic-stem-cell expansion allows nonconditioned transplantation”。除了Nakauchi之外,另一名论文共同通讯作者是东京大学干细胞生物学副教授Satoshi Yamazaki博士。论文第一作者为斯坦福大学博士后学者Adam Wilkinson博士和东京大学高级研究助理Reiko Ishida。
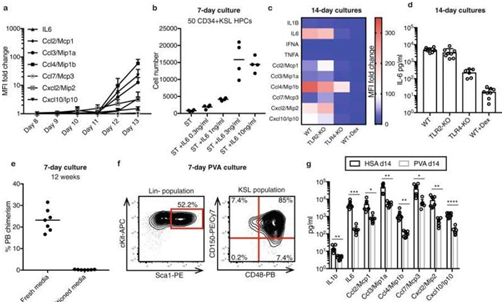
造血干细胞是骨髓中发现的稀有细胞。像其他干细胞一样,它们经分裂后能够产生更多的造血干细胞---一个称为自我更新的过程---或者产生体内所有不同类型的血液细胞和免疫细胞的前体细胞---一个称为分化的过程。
人们早就知道,患有镰状细胞性贫血和白血病等免疫或血液疾病的人能够通过移植健康的造血干细胞来治愈。但为了让这种治疗起作用,受者自身的造血干细胞必须首先被杀死以清除这种疾病,从而为健康的造血干细胞在骨髓中定植腾出空间。
这种清除步骤,也称为“调理(conditioning)”,可以用化疗或放疗,或两者的组合来完成。然而,这种调理能够导致危及生命的副作用。这在儿童患者中尤其如此,他们可能在以后的生活中遭受生长迟缓、不孕和继发性癌症等副作用。重病或老年患者通常不能接受移植,这是因为他们无法忍受这种调理治疗。
“干细胞领域的圣杯”
不过一段时间以来,人们一直在想,移植大量供者造血干细胞是否可以避免清除受者现存造血干细胞的需要。也许,他们推断,给受者骨髓提供一大堆健康的供者细胞将允许新来的供者细胞强行站稳脚跟并产生健康的血液细胞和免疫细胞。
然而,很难测试这一理论,这是因为造血干细胞难以大量分离。尽管多年来人们能够在实验室中培养人类造血干细胞,但是这些细胞从不会自我更新,而且经常放弃干细胞的命运,分化成前体细胞。因此,很难深入研究它们的生物学特性或产生足够的细胞来进行大规模移植。
Nakauchi说道,“扩大造血干细胞的数量一直是干细胞领域的最高目标。当某些东西不起作用时,人们往往会认为缺少了某些东西。但是,我们决定通过清除常规培养系统中的所有杂质来尝试一种相反的方法,同时还优化促进造血干细胞自我更新的其他方面。”
这些研究人员还用聚乙烯醇替代了一种可能受到污染的血液蛋白---血清白蛋白。聚乙烯醇是一种水溶性合成化学物质,经常用于生物医学研究。
对这些细胞培养方式的这些修改使得这些研究人员能够利用仅50个起始细胞产生足够的造血干细胞用于移植。虽然其中的一些造血干细胞确实在培养中发生分化,但是在整个培养期间,更多的造血干细胞仍然保持它们的干细胞特性。
Nakauchi说,“这些原始的50个细胞在28天内增加了大约8000倍。其中,每35个细胞中就有一个仍然是功能性的造血干细胞。”
计划测试人体造血干细胞
这些研究人员估计,原始样本中的造血干细胞数量增加了200~900倍,这是前所未有的扩大水平。当他们将新培养的细胞移植到未经过调理治疗的小鼠体内时,这些小鼠产生来自供者造血干细胞和它们自身造血干细胞的血液细胞和免疫细胞,这就证实这些供者细胞已经定植并保持功能。
Nakauchi说道,“我们还发现,在培养过程中,我们能够使用CRISPR技术来校正原始造血细胞中的任何遗传缺陷。这些经过基因校正的细胞随后能够经增殖后用于移植。这应该允许我们使用患者自己的细胞进行基因治疗。”
Nakauchi和他在斯坦福大学的合作者如今正在小鼠身上测试这种方法。(生物谷 Bioon.com)
参考资料:
Adam C. Wilkinson et al. Long-term ex vivo haematopoietic-stem-cell expansion allows nonconditioned transplantation, Nature (2019). DOI: 10.1038/s41586-019-1244-x.
几十年来,科学家们在实验室中培养大量造血干细胞的尝试一直受阻。这些罕见的骨髓细胞单独负责产生血液和免疫系统中的所有细胞。培养这些细胞的困难严重阻碍了许多研究工作,包括那些让某些癌症或血液疾病患者更容易和更安全地接受干细胞移植或基因治疗的研究工作。
如今,这些研究人员破解了这些密码。通过调整培养这些细胞的营养液中的组分、用于支持它们生长的专门分子和培养它们所需的物理条件,他们首次证实诱导来自小鼠的造血干细胞在短短28天的时间内自我更新数百甚至数千次是可能的。
论文共同通讯作者、斯坦福大学遗传学教授Hiromitsu Nakauchi博士说道,“这是我作为干细胞研究员的人生目标之一。50年来,世界各地实验室的科学家们一直在寻找大量培养这些细胞的方法。如今,我们鉴定出一系列条件,足以让这些细胞的数量在短短一个月内扩大900倍。我们认为这种方法可能引发在人体中开展造血干细胞移植和基因治疗的变革。”
特别地,这些研究人员证实在不首先消除受者自身干细胞群体的情况下,成功地将大量体外培养的造血干细胞移植到小鼠体内是有可能的。如果这种技术也适用于人类,那么它可能在移植前让数千名患有血液疾病或免疫疾病的患者免受严格的放疗或化疗方案。它还可能允许临床医生利用患者自己的经过基因校正的干细胞进行基因治疗。
相关研究结果于2019年5月29日在线发表在Nature期刊上,论文标题为“Long-term ex vivo haematopoietic-stem-cell expansion allows nonconditioned transplantation”。除了Nakauchi之外,另一名论文共同通讯作者是东京大学干细胞生物学副教授Satoshi Yamazaki博士。论文第一作者为斯坦福大学博士后学者Adam Wilkinson博士和东京大学高级研究助理Reiko Ishida。

图片来自Nature (2019),doi:10.1038/s41586-019-1244-x。
造血干细胞是骨髓中发现的稀有细胞。像其他干细胞一样,它们经分裂后能够产生更多的造血干细胞---一个称为自我更新的过程---或者产生体内所有不同类型的血液细胞和免疫细胞的前体细胞---一个称为分化的过程。
人们早就知道,患有镰状细胞性贫血和白血病等免疫或血液疾病的人能够通过移植健康的造血干细胞来治愈。但为了让这种治疗起作用,受者自身的造血干细胞必须首先被杀死以清除这种疾病,从而为健康的造血干细胞在骨髓中定植腾出空间。
这种清除步骤,也称为“调理(conditioning)”,可以用化疗或放疗,或两者的组合来完成。然而,这种调理能够导致危及生命的副作用。这在儿童患者中尤其如此,他们可能在以后的生活中遭受生长迟缓、不孕和继发性癌症等副作用。重病或老年患者通常不能接受移植,这是因为他们无法忍受这种调理治疗。
“干细胞领域的圣杯”
不过一段时间以来,人们一直在想,移植大量供者造血干细胞是否可以避免清除受者现存造血干细胞的需要。也许,他们推断,给受者骨髓提供一大堆健康的供者细胞将允许新来的供者细胞强行站稳脚跟并产生健康的血液细胞和免疫细胞。
然而,很难测试这一理论,这是因为造血干细胞难以大量分离。尽管多年来人们能够在实验室中培养人类造血干细胞,但是这些细胞从不会自我更新,而且经常放弃干细胞的命运,分化成前体细胞。因此,很难深入研究它们的生物学特性或产生足够的细胞来进行大规模移植。
Nakauchi说道,“扩大造血干细胞的数量一直是干细胞领域的最高目标。当某些东西不起作用时,人们往往会认为缺少了某些东西。但是,我们决定通过清除常规培养系统中的所有杂质来尝试一种相反的方法,同时还优化促进造血干细胞自我更新的其他方面。”
这些研究人员还用聚乙烯醇替代了一种可能受到污染的血液蛋白---血清白蛋白。聚乙烯醇是一种水溶性合成化学物质,经常用于生物医学研究。
对这些细胞培养方式的这些修改使得这些研究人员能够利用仅50个起始细胞产生足够的造血干细胞用于移植。虽然其中的一些造血干细胞确实在培养中发生分化,但是在整个培养期间,更多的造血干细胞仍然保持它们的干细胞特性。
Nakauchi说,“这些原始的50个细胞在28天内增加了大约8000倍。其中,每35个细胞中就有一个仍然是功能性的造血干细胞。”
计划测试人体造血干细胞
这些研究人员估计,原始样本中的造血干细胞数量增加了200~900倍,这是前所未有的扩大水平。当他们将新培养的细胞移植到未经过调理治疗的小鼠体内时,这些小鼠产生来自供者造血干细胞和它们自身造血干细胞的血液细胞和免疫细胞,这就证实这些供者细胞已经定植并保持功能。
Nakauchi说道,“我们还发现,在培养过程中,我们能够使用CRISPR技术来校正原始造血细胞中的任何遗传缺陷。这些经过基因校正的细胞随后能够经增殖后用于移植。这应该允许我们使用患者自己的细胞进行基因治疗。”
Nakauchi和他在斯坦福大学的合作者如今正在小鼠身上测试这种方法。(生物谷 Bioon.com)
参考资料:
Adam C. Wilkinson et al. Long-term ex vivo haematopoietic-stem-cell expansion allows nonconditioned transplantation, Nature (2019). DOI: 10.1038/s41586-019-1244-x.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


