2019年8月HIV研究亮点进展
来源:本站原创 2019-08-31 23:59
2019年8月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导
2019年8月31日讯/生物谷BIOON/---人类免疫缺陷病毒(human immunodeficiency virus, HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的8月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Nat Commun:重复精液暴露促进宿主对HIV感染产生抵抗力,只是谁敢尝试呢?
doi:10.1038/s41467-019-11814-5
长期以来,人们认为精液仅能作为HIV-1从男性传播给女性的一种途径。在一项新的研究中,来自美国威斯达研究所和波多黎各大学的研究人员发现频繁和持续的精液暴露能够改变循环免疫细胞和阴道组织免疫细胞(它们是HIV感染的目标)的特征,从而降低了对未来感染的易感性。这一发现挑战了这一长期持有的观点。此外,针对为何世界上少数女性性工作者尽管持续存在高风险的性活动但仍然持续保持HIV阴性,它也提供了一种可能的解释。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Repeated semen exposure decreases cervicovaginal SIVmac251 infection in rhesus macaques”。
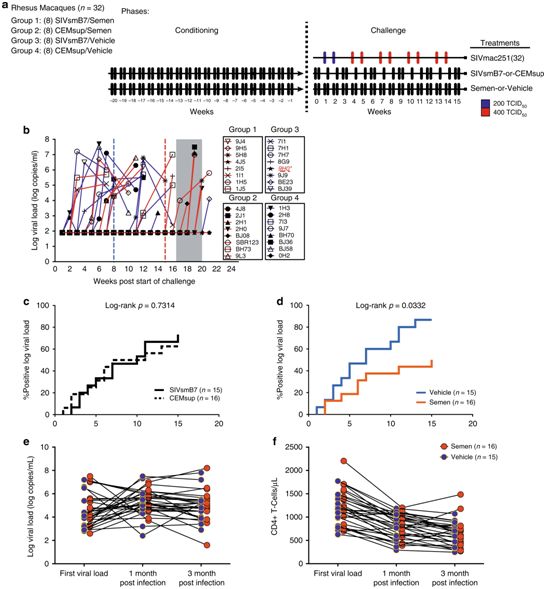
在2015年发表的一项研究中,威斯达研究所疫苗与免疫治疗中心HIV-1免疫发病实验室主任Luis J. Montaner博士与波多黎各大学的研究人员展示了女性性工作者中持续的精液暴露如何导致子宫颈阴道组织的变化,这预示着对HIV感染的抵抗力增强。这项新的研究直接解决了精液是否可能成为抵抗这种感染的一种因素的问题。
Montaner说,“虽然HIV感染已伴随了我们30多年,但这是第一项研究描述了随着时间的推移,精液暴露会如何导致局部组织变化,从而限制人类感染这种病毒。除了确定一种可能调控HIV传播的新因素外,这一意想不到的发现可能直接影响通常招募女性性工作者的未来HIV疫苗研究的设计。当前,不带避孕套的性行为被认为仅能促进感染的可能性。然而,我们的观察提出了一个假设,即经常性的精液暴露可能会减少HIV传播。”
2.JACC子刊:较差的HIV控制增加心力衰竭患者发生心脏性猝死的风险
doi:10.1016/j.jchf.2019.04.025
在一项新的研究中,美国麻省总医院的Raza M. Alvi博士及其同事们发现因心力衰竭(heart failure)住院的HIV感染者随后发生心脏性猝死(sudden cardiac death, SCD)的风险增加了。相关研究结果近期发表在JACC: Heart Failure期刊上,论文标题为“The Risk for Sudden Cardiac Death Among Patients Living With Heart Failure and Human Immunodeficiency Virus”。
这些研究人员回顾性分析了来自单个学术中心的2578例因心力衰竭住院的患者的数据;这些患者中有344名患者为HIV感染者。通过病毒载量评估了SCD的发生率。
这些研究人员发现,86%的患者没有植入式心律转复除颤器(ICD; 344名HIV感染者和1805名未感染上HIV的对照者)。绝大多数发生心力衰竭的HIV感染者接受了抗逆转录病毒治疗(91%),其中64%的HIV感染者体内的病毒受到抑制。在为期19个月的中位随访期间,共出现191例SCD。与对照者相比,HIV感染者发生的SCD增加了三倍(21%对6.4%;校正比值比为3.0)。HIV感染者中的SCD预测因子包括可卡因使用,左心室射血分数降低,β受体阻滞剂处方缺乏,CD4计数降低和病毒载量增加。具有不可检测的病毒载量的HIV感染者具有与未感染HIV的个体相似的SCD发生率。在没有指示需要常规植入式心律转复除颤器的情形下发生心力衰竭的HIV感染者中,SCD的发生率为每年10%。
3.新型纳米工程微针用于HIV药物输送
Novel nano-engineered microneedles for HIV drug delivery
英国工程与物理科学研究理事会(Engineering and Physical Sciences Research Council ,ESPRC)向利物浦大学(University of Liverpool)和贝尔法斯特皇后大学(Queen's University Belfast)的研究人员提供了逾100万英镑资金,用于研究纳米工程微阵列贴片(microarray patches,MAPs)增强长效艾滋病药物的递送的应用。
该项目由贝尔法斯特皇后大学药学院的Ryan Donnelly教授领导。利物浦大学分子和临床药理学教授Marco Siccardi博士和Andrew Owen教授以及化学系教授Steve Rannard是合作伙伴。
这项研究建立在利物浦大学配方技术的基础上,该技术已被许可给天腾纳米有限公司(Tandem Nano Ltd),这是一家最近从利物浦大学(University of Liverpool)分离出来的公司,它将设计和测试一种新型的透皮贴片,这种贴片的表面有数百个微小的突起,被称为微针(microneedles)。在无痛的皮肤应用后,这些微针会溶解并留下治疗或预防艾滋病毒的药物纳米颗粒。这些纳米颗粒将在数周或数月后溶解,因此患者不再需要严格遵守口服方案。
这项研究将利用来自利物浦和贝尔法斯特的世界领先的长效药物输送技术,并利用先进的基于计算机的药代动力学模型、定制的纳米颗粒制造工艺和令人兴奋的新方法来形成MAPs。
4.Cell子刊:揭示早期人类如何逃避免疫缺陷病毒感染,有助开发出阻断HIV感染的新疗法
doi:10.1016/j.chom.2019.08.002
数十万年来,猴子和猿一直受到猿猴免疫缺陷病毒(SIV)的折磨,这种病毒仍然在摧毁非洲的灵长类动物。幸运的是,随着人类从这些早期灵长类动物进化而来,我们获得了一种让我们免受SIV感染的突变,但是至少在20世纪初,这种病毒经过进化后突破我们的防御,从而导致人类免疫缺陷病毒(HIV)产生和艾滋病(AIDS)大流行。如今,艾滋病影响全世界大约3800万人。
在一项新的研究中,来自美国加州大学伯克利分校的研究人员发现了这种很久之前就已存在的人类突变如何干扰SIV感染。这些发现可能为开发新的疗法来阻止HIV和类似的病毒感染提供了新的线索。相关研究结果于2019年8月22日在线发表在Cell Host & Microbe期刊上,论文标题为“Structural Basis for Tetherin Antagonism as a Barrier to Zoonotic Lentiviral Transmission”。
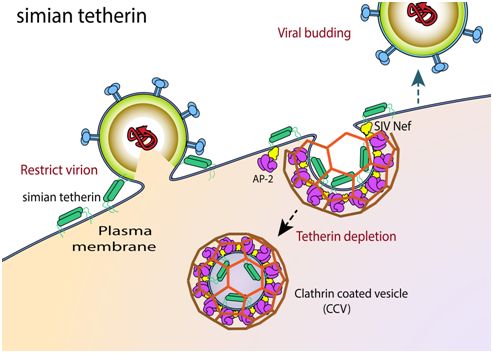
论文共同通讯作者、加州大学伯克利分校和细胞生物学教授James Hurley说:“这篇论文的重要意义在于它告诉我们在这种病毒跳跃到人类之前,最后的主要障碍之一是什么。当前的这篇论文从考古学的角度研究了这是如何发生的。”
这种障碍是人体细胞中发生的一种阻断SIV迫使这些细胞脱落上千个病毒拷贝的突变。结果就是人类不能再彼此感染SIV。
这种基因突变干扰了一种称为Nef的SIV蛋白与两种人类蛋白--- AP-2和tetherin---之间的紧密结合并将它们转移到细胞内将它们破坏而不再抵抗这种病毒的能力。这些研究人员利用低温电镜(cryoEM)解析出这种蛋白复合物的结构,并发现这种突变有效地破坏了Nef蛋白的结合位点,从而使得SIV需要很长时间才能找到应对措施。
5.bioRxiv:从1966年保存的淋巴结样本中提取出HIV-1基因组
doi:10.1101/687863
在一项新的研究中,来自美国、比利时和刚果民主共和国的研究人员从一种已在石蜡中保存了50多年的淋巴结组织中提取出近乎完整的HIV-1基因组。这种样本是迄今为止发现的最早的HIV-1基因组,比此前最古老的样本早了十年。相关研究结果近期发表在预印本服务器bioRxiv上,论文标题为“A near-full-length HIV-1 genome from 1966 recovered from formalin-fixed paraffin-embedded tissue”。
在从刚果民主共和国的一名38岁男子体内收集受到污染的淋巴结17年后,即1983年,科学家们首次发现了HIV-1病毒。在1966年获取这种淋巴结样本后,病理学家用福尔马林固定这种组织并将它包埋在石蜡中,然后将它储存了大约半个世纪。许多此类组织样本都被存档以便在未来希望能更好地了解当时未知的疾病。
论文共同作者Michael Worobey和他的同事们在刚果民主共和国金沙萨大学梳理了1600多个组织样本旨在寻找HIV基因组片段时,发现了这种大小不超过手指甲的淋巴结样本。在这些大量的组织样本中,仅这种淋巴结样本含有这种病毒的迹象。这种淋巴结样本的保存过程让RNA发生破碎,但是这些研究人员成功地提取出和组装足够多的HIV基因组片段,从而形成接近完整的HIV基因组。
6.Nat Commun:首次利用CRISPR从活动物基因组中清除HIV
doi:10.1038/s41467-019-10366-y
坦普尔大学刘易斯·卡茨医学院(LKSOM)和内布拉斯加大学医学中心(UNMC)的研究人员进行了一次重大合作,首次从活动物的基因组中消除了可复制的HIV-1 DNA,这是一种导致艾滋病的病毒。这项研究于近日在线发表在《Nature Communications》杂志上,它标志着人类艾滋病病毒(HIV)感染可能治愈的关键一步。
"我们的研究显示,先后进行抑制艾滋病毒复制的治疗和基因编辑疗法可以从感染动物的细胞和器官中消除艾滋病毒。" Kamel Khalili博士说道,他是LKSOM的Laura H. Carnell教授、神经科学系主任、神经病毒学中心主任、综合神经艾滋病中心主任。Khalili博士和传染病和UNMC内科教授、药理学和实验神经科学系主任、神经退行性疾病中心主任Howard Gendelman博士是这项新研究的通讯作者。
在之前的工作中,Khalili博士的团队使用CRISPR-Cas9技术开发了一种新的基因编辑和基因治疗传递系统,旨在从HIV病毒的基因组中去除DNA。在大鼠和小鼠中,他们发现基因编辑系统可以有效地从感染细胞中去除大量的HIV DNA片段,显着影响病毒基因的表达。然而,与ART类似,基因编辑本身不能完全消除艾滋病毒。
在这项新研究中,Khalili博士和同事们将他们的基因编辑系统与最近开发的一种名为长效缓释(激光)技术的治疗策略相结合。激光技术是由Gendelman博士和UNMC药理学助理教授Benson Edagwa博士共同开发的。激光抗逆转录病毒治疗以病毒避难所为目标,在较长时间内维持低水平的艾滋病毒复制,从而降低抗逆转录病毒治疗的频率。由于抗逆转录病毒药物的化学结构发生了药理学上的变化,这些长效药物得以问世。这种经过修饰的药物被包装成纳米晶体,纳米晶体很容易分布到HIV可能潜伏的组织中。从那里,储存在细胞内数周的纳米晶体慢慢释放药物。
研究人员用老鼠来制造易受HIV感染的人类T细胞,允许长期的病毒感染和ART诱导的潜伏期。一旦感染被确定,小鼠接受激光治疗,随后使用CRISPR-Cas9治疗。在疗程结束时,对小鼠进行病毒载量检测。分析显示,大约三分之一的感染艾滋病毒的小鼠体内的艾滋病毒DNA完全消失。
7.Nat Commu:艾滋病毒通过细胞间直接接触传播
doi:10.1038/s41467-019-09879-3
像人类免疫缺陷病毒(HIV)这样的病原体的传播常常是在试管中(即在二维细胞培养中)进行研究的,尽管它几乎不能反映人体中更为复杂的情况。而近日海德堡大学的一个跨学科的科学家团队利用创新的细胞培养系统、定量图像分析和计算机模拟,探索了艾滋病毒如何在三维组织样环境中传播。研究人员的结果表明,这种组织结构迫使病毒通过细胞间的直接接触传播。
尽管经过30多年的研究,但艾滋病毒许多关键方面(如艾滋病毒如何传播)仍然不为人知。这些尚未解决的问题之一涉及病毒与人体环境之间的相互作用。传统上认为,受感染的细胞释放病毒颗粒,然后扩散,最终感染其他细胞。但也有可能病毒颗粒通过密切接触直接从一个受感染的细胞转移到另一个细胞。到目前为止,还不清楚哪些传播方式在组织中普遍存在。海德堡大学医院(Heidelberg University Hospital)综合传染病研究中心(CIID)的研究主任Oliver Fackler教授解释说:"实验室中关于艾滋病毒复制的研究大多是在简单的塑料培养皿中进行的细胞培养实验,这些实验并不反映组织的复杂结构和异质性。"
海德堡大学的研究人员在他们的研究方法中考虑到所谓的CD4 T辅助细胞(HIV病毒感染的首选细胞类型)在生理环境中具有高度的运动性。他们使用了一种新的细胞培养系统,在胶原蛋白的帮助下生成了一个三维支架。这使得研究人员可以在数周的过程中在组织样的环境中维持细胞的移动性,并监测感染HIV-1的初级CD4 T细胞。利用这种创新的方法,研究人员测量了许多因素,这些因素表征了细胞活力、病毒复制和CD4 T辅助细胞的逐渐丧失。"这产生了一组非常复杂的数据,如果没有其他学科科学家的帮助,这些数据是无法解释的," Andrea Imle博士解释说道,她在CIID攻读博士期间参与了这个项目。
8.Clin Infect Dis:HIV感染或会明显增加患者患多种疾病的风险
doi:10.1093/cid/ciz539
HIV感染者在其一生中往往更易于出现其它健康问题,近日,一项刊登在国际杂志Clinical Infectious Diseases上的研究报告中,来自维也纳医科大学的科学家们通过对涉及HIV的3000多项研究进行综合分析后发现了多项健康后果或与HIV感染有关,其中有8项明确归因于引发AIDS的病原体—HIV。

文章中,研究人员利用了一种相对较新的统计学工具来进行荟萃分析,该工具能对代表最高水平证据的综合性分析进行深入阐释,研究者纳入了20项综合性分析的结果,其中包括3200项与HIV感染相关的人群健康结果方面的研究。
尽管荟萃分析共确定了55项与HIV感染相关的人群健康结果,但进一步分析后研究者发现,其中只有37项健康结果与HIV感染明显相关,8项健康结果具有与HIV相关的暗示性证据,这些疾病包括COPD(慢性阻塞性肺病)、呼吸困难、咳嗽、贫血、产妇败血症、妊娠相关死亡率、骨折和缺血性心脏病。
研究者Igor Grabovac说道,HIV感染者患在其一生中患多种疾病的风险往往较高,在澳大利亚,大约98%的HIV感染者都能通过服药来控制疾病症状和进展,尽管感染者具有较好的预期寿命,但其相比非HIV感染者而言却会患上更多慢性疾病;后期研究人员还需要深入研究来阐明为何HIV感染者会出现多种其它健康问题,一种可能性的原因包括服药所产生的副作用、生活方式或病毒自身,由于个体体内存在慢性感染,上述因素也会导致患者机体细胞加速衰老。
9.Science子刊:HIV疫苗新策略!利用抗独特型抗体激活表达广泛中和抗体的前体B细胞
doi:10.1126/scitranslmed.aay7699
诱导保护性的广泛中和抗体(broadly neutralizing antibody, bNAb)产生是成功接种疫苗的关键策略。然而,对于许多重要的全球性疾病,如艾滋病和流感,人们尚未实现高效的疫苗接种。一种开发新疫苗的策略专注于鉴定出病原体上的特定脆弱靶标,疫苗诱导出的保护性抗体应当能够靶向这些脆弱的靶标。对于HIV感染而言,这种方法专注于鉴定bNAb的靶标,bNAb是在一小部分HIV感染者体内产生的,并且可以介导免受多种HIV毒株的入侵。尽管已鉴定出针对HIV-1包膜蛋白(Env)的多个bNAb靶标,但迄今为止,基于特定结构的Env免疫原的多种疫苗方法未能在人体中诱导出保护性的bNAb。
在一项新的研究中,为了采取一种新方法来解决这个问题,Bancroft等人研究了是否能够利用抗独特型抗体(anti-idiotype antibody)进行疫苗接种。他们以产生一种称为b12的HIV-1 bNAb的生殖系B细胞作为研究对象,对这种HIV-1 bNAb而言,它能够识别的Env免疫原尚未被鉴定出。
为此,这些作者根据推断的bNAb b12生殖系版本开发出针对它的特异性抗独特型抗体。所产生的生殖系抗独特型抗体能够成功地从未感染HIV的供者体内的多克隆人B细胞库中鉴定出反应性的B细胞。然而,抗独特型抗体反应性的B细胞表达的B细胞受体与预测的生殖系b12前体分子仅具有中度的相似性。这种代表性不足可能是由于生殖系b12前体B细胞的自身反应性,这种自身反应性可导致这些特异性的B细胞在一种小鼠重链敲入模型中的缺失和无反应性。尽管如此,利用抗独特型抗体进行免疫接种克服了B细胞无反应性,从而导致靶B细胞的活化和靶B细胞进入生发中心。
10.Cell子刊:研究破译艾滋病毒保护层的组成成分
doi:10.1016/j.chom.2019.07.007; doi:10.1016/j.celrep.2019.07.079
HIV-1病毒的基因组由一种称为衣壳的锥形蛋白质外壳保护,衣壳对病毒感染起着许多至关重要的作用--保护病毒不受免疫系统的影响,连接到细胞的运输网络,劫持细胞机制进行繁殖。衣壳由数百个病毒蛋白组成,它们形成特定的模式,其中一些会激发宿主细胞的防御能力,另一些则有助于病毒感染的传播。
耶鲁大学的研究人员在分子生物物理学和生物化学教授Yong Xiong实验室的研究生Brady Summers的带领下,设计了一种方法来捕捉HIV-1病毒的单个蛋白模式,并揭示它们在感染期间的影响。Xiong说:"这些蛋白质片段就像乐高积木一样,是衣壳的基本组成部分,每一个都有不同的功能。例如,研究中的一个这样的片段使衣壳能够附着在细胞骨架上,在细胞内移动。了解每种模式的功能可以帮助研究人员增强引起宿主防御的相互作用的效果,或者阻止那些促进感染的相互作用。"
11.JCI:蛋白BRD4选择性的小分子可抑制HIV感染
doi:10.1172/JCI120633
在一项新的研究中,来自美国德克萨斯大学加尔维斯顿医学分部的研究人员发现了一种潜在药物作用于HIV感染者体内,从而进一步抑制这种一直存在但却悄无声息的病毒,而现有的HIV治疗方法无法对抗这种潜伏性的病毒。虽然这种潜在的新药可能补充当前的抗逆转录病毒治疗(ART)药物,但它也可能在不需要终生服用ART药物的情形下导致HIV缓解。相关研究结果近期发表在Journal of Clinical Investigation期刊上,论文标题为“Structure-guided drug design identifies a BRD4-selective small molecule that suppresses HIV”。
论文共同通讯作者、德克萨斯大学加尔维斯顿医学分部微生物学与免疫学系助理教授Haitao Hu说道,“我们在世界上首次证实人BRD4蛋白及其相关的复合物能够被用来抑制潜伏的HIV。我们的研究结果令人兴奋,这是因为它们不仅提高了我们对HIV表观遗传调控生物学的理解,而且它们还为开发沉默HIV的探针和/或治疗试剂提供一种有前景的方法,这最终有望导致人们治愈HIV感染。”
在这项实验室研究中,这些研究人员发现蛋白BRD4在调节HIV基因新拷贝的产生中起着重要作用。他们成功地设计、合成和评估了一系列小分子,以便选择性地对BRD4进行编程来抑制HIV,并且从中鉴定出一种称为ZL0580的先导化合物。他们在HIV感染模型中测试了这种先导化合物,并发现在接受ART药物治疗的HIV感染者的血细胞中,在ART药物停用后,它显著延迟了HIV重新激活。
12.Science子刊:重大进展!duoCAR-T细胞在确保不被HIV感染的同时高效抑制HIV
doi:10.1126/scitranslmed.aav5685
在一项新的研究中,来自美国生物技术公司Lentigen、阿尔伯特-爱因斯坦医学院、美国国家癌症研究所、阿拉巴马大学伯明翰分校、伯明翰退伍军人医疗中心和匹兹堡大学的研究人员发现他们构建的duoCAR-T细胞在人源化小鼠模型中有效地抵抗HIV。相关研究结果发表在2019年8月7日的Science Translational Medicine期刊上,论文标题为“Multispecific anti-HIV duoCAR-T cells display broad in vitro antiviral activity and potent in vivo elimination of HIV-infected cells in a humanized mouse model”。在这篇论文中,他们描述了如何构建duoCAR-T细胞以及它们如何很好地在人源化小鼠模型中发挥作用。
嵌合抗原受体(CAR)-T细胞(CAR-T)是对从患者体内取出的T细胞进行基因改造而获得新特性后产生的。在最近的一些病例中,它们发生改变的方式促使它们更有效地攻击癌细胞。这种技术涉及添加编码一种受体的基因,所编码的受体结合仅在癌细胞中发现的蛋白。几年前,一组研究人员在HIV感染者中尝试了这种技术。经证实,它在某些情况下是有效的,但是科学家们发现CAR-T细胞本身很容易被这种病毒感染。
在这项新的研究中,这些研究人员采用了一种更新的方法来使用CAR-T细胞来对抗HIV,让它们的CAR分子加倍。由此所获得的细胞被命名为duoCAR-T细胞。他们报道这种新方法的优势在于它靶向HIV包膜上的多个位点,而不是让T细胞发生改变后以CD4受体作为靶向位点。所使用的这两种特定的CAR分子是在开发40多种慢病毒载体并测试它们以观察哪种慢病毒载体是最有效的过程中发现的。
这些研究人员报道,在实验室测试时,他们的duoCAR-T细胞消除了大约99%的受感染的免疫细胞品系。当在人类小鼠模型上进行测试时,duoCAR-T细胞的剂量在治疗仅一周后能够抑制97%的HIV感染---远远优于传统的CAR-T细胞。他们还报道,duoCAR-T细胞经证实对HIV感染有抵抗力,这就克服了传统使用CAR-T细胞治疗HIV患者所面临的一个主要问题。最后,他们报道旨在测试这种新方法的有效性和安全性的临床试验计划最早在明年春天开始。
13.JAIDS:苯二氮卓类药物和肌肉松弛剂与HIV患者严重跌倒相关联
doi:10.1097/QAI.0000000000002130
在一项新的研究中,美国研究人员发现苯二氮卓类药物(benzodiazepines)和肌肉松弛剂与50多岁的HIV患者的严重跌倒有关。相关研究结果近期发表在Journal of Acquired Immune Deficiency Syndrome期刊上,论文标题为“Polypharmacy, hazardous alcohol and illicit substance use and serious falls among PLWH and uninfected comparators”。
美国弗吉尼亚州康涅狄格医疗系统的Julie A. Womack博士及其同事们研究了用药过多、有害酒精使用和违禁物使用与严重跌倒之间的关系是否因退伍军人老龄化队列研究(Veterans Aging Cohort Study)参与者的HIV状态而有所不同。有13530人经历过跌倒。根据年龄、种族、性别、HIV状况、观察时间和基线日期,这些病例与67060名对照者相匹配。
这些研究人员发现,在HIV感染者中,苯二氮卓类药物(比值比[OR] 1.24)和肌肉松弛剂(OR,1.29)与严重跌倒有关,但是他们在未感染者中并未观察到这一点。这两组人群发生跌倒的主要风险因素包括非抗逆转录病毒药物(五种药物中的每种; OR,1.20),违禁物使用/滥用(OR,1.44),有害酒精使用(OR,1.30)和阿片类药物处方(OR,1.35)。
14.eLife:研究发现新的抗病毒蛋白
doi:10.7554/eLife.46767
根据发表在《eLife》杂志上的新发现,一种名为KHNYN的新蛋白质已被确认为一种天然抗病毒系统中缺失的部分。研究人体对病毒的自然防御以及病毒如何进化以逃避抗病毒机制对于开发新的疫苗、药物和抗癌疗法至关重要。
构成许多病毒基因组的遗传信息由RNA核苷酸组成。最近,人们发现一种叫做ZAP的蛋白质与特定的RNA核苷酸序列结合:胞嘧啶和鸟苷,简称CpG。
人类免疫缺陷病毒(HIV)通常不会受到ZAP的抑制,因为它已经进化到基因组中只有很少的CpG。然而,当CpGs被添加回病毒时,ZAP会促进其破坏。这有助于我们理解为什么拥有更多CpG的艾滋病毒繁殖不那么成功,并可能解释为什么许多艾滋病毒菌株进化成拥有较少CpG的。但是一个谜团仍然存在,因为ZAP无法单独分解病毒RNA。
"由于ZAP本身不能降解RNA,我们认为它必须招募其他蛋白质到病毒RNA中来破坏它,"首席作者Mattia Ficarelli说,她是伦敦国王学院传染病系Chad Swanson实验室的博士生。"因此,在目前的研究中,我们开始鉴定新的人类蛋白质,这些蛋白质对于ZAP以病毒RNA为靶点进行破坏至关重要。"
在发现KHNYN与ZAP相互作用后,研究小组测试了当他们增加细胞中产生的KHNYN的数量时所发生的情况。细胞中KHNYN产量的增加使典型HIV的增殖能力降低了约为5倍,并降低了富含CpG的HIV的增殖能力约为400倍。
为了弄清楚KHNYN和ZAP是否协同工作,研究小组在没有ZAP的细胞中重复了同样的实验,并发现KHNYN并不会抑制富含CpG的HIV的增殖能力。然后他们观察了基因工程细胞中缺少KHNYN的情况,发现富含CpG的HIV和含有许多CpG的小鼠白血病病毒都不再受到ZAP的抑制。(生物谷 Bioon.com)
自上世纪八十年代以来,艾滋病的流行已经夺去超过3400万人的生命。据世界卫生组织(WHO)统计,据估计,2017年,全世界有3690万人感染上HIV,其中仅59%的HIV感染者接受抗逆转录病毒疗法(ART)治疗。目前为止HIV仍然是全球最大的公共卫生挑战之一,因此急需深入研究HIV的功能,以帮助研究人员开发出可以有效对抗这种疾病的新疗法。为阻止病毒大量复制对免疫系统造成损害,HIV感染者需要每天甚至终身服用ART。虽然服用ART已被证明能有效抑制艾滋病发作,但这类药物价格昂贵、耗时耗力且副作用严重。人们急需找到治愈HIV感染的方法。
即将过去的8月份,有哪些重大的HIV研究或发现呢?生物谷小编梳理了一下这个月生物谷报道的HIV研究方面的新闻,供大家阅读。
1.Nat Commun:重复精液暴露促进宿主对HIV感染产生抵抗力,只是谁敢尝试呢?
doi:10.1038/s41467-019-11814-5
长期以来,人们认为精液仅能作为HIV-1从男性传播给女性的一种途径。在一项新的研究中,来自美国威斯达研究所和波多黎各大学的研究人员发现频繁和持续的精液暴露能够改变循环免疫细胞和阴道组织免疫细胞(它们是HIV感染的目标)的特征,从而降低了对未来感染的易感性。这一发现挑战了这一长期持有的观点。此外,针对为何世界上少数女性性工作者尽管持续存在高风险的性活动但仍然持续保持HIV阴性,它也提供了一种可能的解释。相关研究结果近期发表在Nature Communications期刊上,论文标题为“Repeated semen exposure decreases cervicovaginal SIVmac251 infection in rhesus macaques”。

图片来自Nature Communications, 2019, doi:10.1038/s41467-019-11814-5。
在2015年发表的一项研究中,威斯达研究所疫苗与免疫治疗中心HIV-1免疫发病实验室主任Luis J. Montaner博士与波多黎各大学的研究人员展示了女性性工作者中持续的精液暴露如何导致子宫颈阴道组织的变化,这预示着对HIV感染的抵抗力增强。这项新的研究直接解决了精液是否可能成为抵抗这种感染的一种因素的问题。
Montaner说,“虽然HIV感染已伴随了我们30多年,但这是第一项研究描述了随着时间的推移,精液暴露会如何导致局部组织变化,从而限制人类感染这种病毒。除了确定一种可能调控HIV传播的新因素外,这一意想不到的发现可能直接影响通常招募女性性工作者的未来HIV疫苗研究的设计。当前,不带避孕套的性行为被认为仅能促进感染的可能性。然而,我们的观察提出了一个假设,即经常性的精液暴露可能会减少HIV传播。”
2.JACC子刊:较差的HIV控制增加心力衰竭患者发生心脏性猝死的风险
doi:10.1016/j.jchf.2019.04.025
在一项新的研究中,美国麻省总医院的Raza M. Alvi博士及其同事们发现因心力衰竭(heart failure)住院的HIV感染者随后发生心脏性猝死(sudden cardiac death, SCD)的风险增加了。相关研究结果近期发表在JACC: Heart Failure期刊上,论文标题为“The Risk for Sudden Cardiac Death Among Patients Living With Heart Failure and Human Immunodeficiency Virus”。
这些研究人员回顾性分析了来自单个学术中心的2578例因心力衰竭住院的患者的数据;这些患者中有344名患者为HIV感染者。通过病毒载量评估了SCD的发生率。
这些研究人员发现,86%的患者没有植入式心律转复除颤器(ICD; 344名HIV感染者和1805名未感染上HIV的对照者)。绝大多数发生心力衰竭的HIV感染者接受了抗逆转录病毒治疗(91%),其中64%的HIV感染者体内的病毒受到抑制。在为期19个月的中位随访期间,共出现191例SCD。与对照者相比,HIV感染者发生的SCD增加了三倍(21%对6.4%;校正比值比为3.0)。HIV感染者中的SCD预测因子包括可卡因使用,左心室射血分数降低,β受体阻滞剂处方缺乏,CD4计数降低和病毒载量增加。具有不可检测的病毒载量的HIV感染者具有与未感染HIV的个体相似的SCD发生率。在没有指示需要常规植入式心律转复除颤器的情形下发生心力衰竭的HIV感染者中,SCD的发生率为每年10%。
3.新型纳米工程微针用于HIV药物输送
Novel nano-engineered microneedles for HIV drug delivery
英国工程与物理科学研究理事会(Engineering and Physical Sciences Research Council ,ESPRC)向利物浦大学(University of Liverpool)和贝尔法斯特皇后大学(Queen's University Belfast)的研究人员提供了逾100万英镑资金,用于研究纳米工程微阵列贴片(microarray patches,MAPs)增强长效艾滋病药物的递送的应用。
该项目由贝尔法斯特皇后大学药学院的Ryan Donnelly教授领导。利物浦大学分子和临床药理学教授Marco Siccardi博士和Andrew Owen教授以及化学系教授Steve Rannard是合作伙伴。
这项研究建立在利物浦大学配方技术的基础上,该技术已被许可给天腾纳米有限公司(Tandem Nano Ltd),这是一家最近从利物浦大学(University of Liverpool)分离出来的公司,它将设计和测试一种新型的透皮贴片,这种贴片的表面有数百个微小的突起,被称为微针(microneedles)。在无痛的皮肤应用后,这些微针会溶解并留下治疗或预防艾滋病毒的药物纳米颗粒。这些纳米颗粒将在数周或数月后溶解,因此患者不再需要严格遵守口服方案。
这项研究将利用来自利物浦和贝尔法斯特的世界领先的长效药物输送技术,并利用先进的基于计算机的药代动力学模型、定制的纳米颗粒制造工艺和令人兴奋的新方法来形成MAPs。
4.Cell子刊:揭示早期人类如何逃避免疫缺陷病毒感染,有助开发出阻断HIV感染的新疗法
doi:10.1016/j.chom.2019.08.002
数十万年来,猴子和猿一直受到猿猴免疫缺陷病毒(SIV)的折磨,这种病毒仍然在摧毁非洲的灵长类动物。幸运的是,随着人类从这些早期灵长类动物进化而来,我们获得了一种让我们免受SIV感染的突变,但是至少在20世纪初,这种病毒经过进化后突破我们的防御,从而导致人类免疫缺陷病毒(HIV)产生和艾滋病(AIDS)大流行。如今,艾滋病影响全世界大约3800万人。
在一项新的研究中,来自美国加州大学伯克利分校的研究人员发现了这种很久之前就已存在的人类突变如何干扰SIV感染。这些发现可能为开发新的疗法来阻止HIV和类似的病毒感染提供了新的线索。相关研究结果于2019年8月22日在线发表在Cell Host & Microbe期刊上,论文标题为“Structural Basis for Tetherin Antagonism as a Barrier to Zoonotic Lentiviral Transmission”。

图片来自UC Berkeley image by Cosmo Buffalo。
论文共同通讯作者、加州大学伯克利分校和细胞生物学教授James Hurley说:“这篇论文的重要意义在于它告诉我们在这种病毒跳跃到人类之前,最后的主要障碍之一是什么。当前的这篇论文从考古学的角度研究了这是如何发生的。”
这种障碍是人体细胞中发生的一种阻断SIV迫使这些细胞脱落上千个病毒拷贝的突变。结果就是人类不能再彼此感染SIV。
这种基因突变干扰了一种称为Nef的SIV蛋白与两种人类蛋白--- AP-2和tetherin---之间的紧密结合并将它们转移到细胞内将它们破坏而不再抵抗这种病毒的能力。这些研究人员利用低温电镜(cryoEM)解析出这种蛋白复合物的结构,并发现这种突变有效地破坏了Nef蛋白的结合位点,从而使得SIV需要很长时间才能找到应对措施。
5.bioRxiv:从1966年保存的淋巴结样本中提取出HIV-1基因组
doi:10.1101/687863
在一项新的研究中,来自美国、比利时和刚果民主共和国的研究人员从一种已在石蜡中保存了50多年的淋巴结组织中提取出近乎完整的HIV-1基因组。这种样本是迄今为止发现的最早的HIV-1基因组,比此前最古老的样本早了十年。相关研究结果近期发表在预印本服务器bioRxiv上,论文标题为“A near-full-length HIV-1 genome from 1966 recovered from formalin-fixed paraffin-embedded tissue”。
在从刚果民主共和国的一名38岁男子体内收集受到污染的淋巴结17年后,即1983年,科学家们首次发现了HIV-1病毒。在1966年获取这种淋巴结样本后,病理学家用福尔马林固定这种组织并将它包埋在石蜡中,然后将它储存了大约半个世纪。许多此类组织样本都被存档以便在未来希望能更好地了解当时未知的疾病。
论文共同作者Michael Worobey和他的同事们在刚果民主共和国金沙萨大学梳理了1600多个组织样本旨在寻找HIV基因组片段时,发现了这种大小不超过手指甲的淋巴结样本。在这些大量的组织样本中,仅这种淋巴结样本含有这种病毒的迹象。这种淋巴结样本的保存过程让RNA发生破碎,但是这些研究人员成功地提取出和组装足够多的HIV基因组片段,从而形成接近完整的HIV基因组。
6.Nat Commun:首次利用CRISPR从活动物基因组中清除HIV
doi:10.1038/s41467-019-10366-y
坦普尔大学刘易斯·卡茨医学院(LKSOM)和内布拉斯加大学医学中心(UNMC)的研究人员进行了一次重大合作,首次从活动物的基因组中消除了可复制的HIV-1 DNA,这是一种导致艾滋病的病毒。这项研究于近日在线发表在《Nature Communications》杂志上,它标志着人类艾滋病病毒(HIV)感染可能治愈的关键一步。
"我们的研究显示,先后进行抑制艾滋病毒复制的治疗和基因编辑疗法可以从感染动物的细胞和器官中消除艾滋病毒。" Kamel Khalili博士说道,他是LKSOM的Laura H. Carnell教授、神经科学系主任、神经病毒学中心主任、综合神经艾滋病中心主任。Khalili博士和传染病和UNMC内科教授、药理学和实验神经科学系主任、神经退行性疾病中心主任Howard Gendelman博士是这项新研究的通讯作者。
在之前的工作中,Khalili博士的团队使用CRISPR-Cas9技术开发了一种新的基因编辑和基因治疗传递系统,旨在从HIV病毒的基因组中去除DNA。在大鼠和小鼠中,他们发现基因编辑系统可以有效地从感染细胞中去除大量的HIV DNA片段,显着影响病毒基因的表达。然而,与ART类似,基因编辑本身不能完全消除艾滋病毒。
在这项新研究中,Khalili博士和同事们将他们的基因编辑系统与最近开发的一种名为长效缓释(激光)技术的治疗策略相结合。激光技术是由Gendelman博士和UNMC药理学助理教授Benson Edagwa博士共同开发的。激光抗逆转录病毒治疗以病毒避难所为目标,在较长时间内维持低水平的艾滋病毒复制,从而降低抗逆转录病毒治疗的频率。由于抗逆转录病毒药物的化学结构发生了药理学上的变化,这些长效药物得以问世。这种经过修饰的药物被包装成纳米晶体,纳米晶体很容易分布到HIV可能潜伏的组织中。从那里,储存在细胞内数周的纳米晶体慢慢释放药物。
研究人员用老鼠来制造易受HIV感染的人类T细胞,允许长期的病毒感染和ART诱导的潜伏期。一旦感染被确定,小鼠接受激光治疗,随后使用CRISPR-Cas9治疗。在疗程结束时,对小鼠进行病毒载量检测。分析显示,大约三分之一的感染艾滋病毒的小鼠体内的艾滋病毒DNA完全消失。
7.Nat Commu:艾滋病毒通过细胞间直接接触传播
doi:10.1038/s41467-019-09879-3
像人类免疫缺陷病毒(HIV)这样的病原体的传播常常是在试管中(即在二维细胞培养中)进行研究的,尽管它几乎不能反映人体中更为复杂的情况。而近日海德堡大学的一个跨学科的科学家团队利用创新的细胞培养系统、定量图像分析和计算机模拟,探索了艾滋病毒如何在三维组织样环境中传播。研究人员的结果表明,这种组织结构迫使病毒通过细胞间的直接接触传播。
尽管经过30多年的研究,但艾滋病毒许多关键方面(如艾滋病毒如何传播)仍然不为人知。这些尚未解决的问题之一涉及病毒与人体环境之间的相互作用。传统上认为,受感染的细胞释放病毒颗粒,然后扩散,最终感染其他细胞。但也有可能病毒颗粒通过密切接触直接从一个受感染的细胞转移到另一个细胞。到目前为止,还不清楚哪些传播方式在组织中普遍存在。海德堡大学医院(Heidelberg University Hospital)综合传染病研究中心(CIID)的研究主任Oliver Fackler教授解释说:"实验室中关于艾滋病毒复制的研究大多是在简单的塑料培养皿中进行的细胞培养实验,这些实验并不反映组织的复杂结构和异质性。"
海德堡大学的研究人员在他们的研究方法中考虑到所谓的CD4 T辅助细胞(HIV病毒感染的首选细胞类型)在生理环境中具有高度的运动性。他们使用了一种新的细胞培养系统,在胶原蛋白的帮助下生成了一个三维支架。这使得研究人员可以在数周的过程中在组织样的环境中维持细胞的移动性,并监测感染HIV-1的初级CD4 T细胞。利用这种创新的方法,研究人员测量了许多因素,这些因素表征了细胞活力、病毒复制和CD4 T辅助细胞的逐渐丧失。"这产生了一组非常复杂的数据,如果没有其他学科科学家的帮助,这些数据是无法解释的," Andrea Imle博士解释说道,她在CIID攻读博士期间参与了这个项目。
8.Clin Infect Dis:HIV感染或会明显增加患者患多种疾病的风险
doi:10.1093/cid/ciz539
HIV感染者在其一生中往往更易于出现其它健康问题,近日,一项刊登在国际杂志Clinical Infectious Diseases上的研究报告中,来自维也纳医科大学的科学家们通过对涉及HIV的3000多项研究进行综合分析后发现了多项健康后果或与HIV感染有关,其中有8项明确归因于引发AIDS的病原体—HIV。

感染人细胞的HIV,图片来自NIH。
尽管荟萃分析共确定了55项与HIV感染相关的人群健康结果,但进一步分析后研究者发现,其中只有37项健康结果与HIV感染明显相关,8项健康结果具有与HIV相关的暗示性证据,这些疾病包括COPD(慢性阻塞性肺病)、呼吸困难、咳嗽、贫血、产妇败血症、妊娠相关死亡率、骨折和缺血性心脏病。
研究者Igor Grabovac说道,HIV感染者患在其一生中患多种疾病的风险往往较高,在澳大利亚,大约98%的HIV感染者都能通过服药来控制疾病症状和进展,尽管感染者具有较好的预期寿命,但其相比非HIV感染者而言却会患上更多慢性疾病;后期研究人员还需要深入研究来阐明为何HIV感染者会出现多种其它健康问题,一种可能性的原因包括服药所产生的副作用、生活方式或病毒自身,由于个体体内存在慢性感染,上述因素也会导致患者机体细胞加速衰老。
9.Science子刊:HIV疫苗新策略!利用抗独特型抗体激活表达广泛中和抗体的前体B细胞
doi:10.1126/scitranslmed.aay7699
诱导保护性的广泛中和抗体(broadly neutralizing antibody, bNAb)产生是成功接种疫苗的关键策略。然而,对于许多重要的全球性疾病,如艾滋病和流感,人们尚未实现高效的疫苗接种。一种开发新疫苗的策略专注于鉴定出病原体上的特定脆弱靶标,疫苗诱导出的保护性抗体应当能够靶向这些脆弱的靶标。对于HIV感染而言,这种方法专注于鉴定bNAb的靶标,bNAb是在一小部分HIV感染者体内产生的,并且可以介导免受多种HIV毒株的入侵。尽管已鉴定出针对HIV-1包膜蛋白(Env)的多个bNAb靶标,但迄今为止,基于特定结构的Env免疫原的多种疫苗方法未能在人体中诱导出保护性的bNAb。
在一项新的研究中,为了采取一种新方法来解决这个问题,Bancroft等人研究了是否能够利用抗独特型抗体(anti-idiotype antibody)进行疫苗接种。他们以产生一种称为b12的HIV-1 bNAb的生殖系B细胞作为研究对象,对这种HIV-1 bNAb而言,它能够识别的Env免疫原尚未被鉴定出。
为此,这些作者根据推断的bNAb b12生殖系版本开发出针对它的特异性抗独特型抗体。所产生的生殖系抗独特型抗体能够成功地从未感染HIV的供者体内的多克隆人B细胞库中鉴定出反应性的B细胞。然而,抗独特型抗体反应性的B细胞表达的B细胞受体与预测的生殖系b12前体分子仅具有中度的相似性。这种代表性不足可能是由于生殖系b12前体B细胞的自身反应性,这种自身反应性可导致这些特异性的B细胞在一种小鼠重链敲入模型中的缺失和无反应性。尽管如此,利用抗独特型抗体进行免疫接种克服了B细胞无反应性,从而导致靶B细胞的活化和靶B细胞进入生发中心。
10.Cell子刊:研究破译艾滋病毒保护层的组成成分
doi:10.1016/j.chom.2019.07.007; doi:10.1016/j.celrep.2019.07.079
HIV-1病毒的基因组由一种称为衣壳的锥形蛋白质外壳保护,衣壳对病毒感染起着许多至关重要的作用--保护病毒不受免疫系统的影响,连接到细胞的运输网络,劫持细胞机制进行繁殖。衣壳由数百个病毒蛋白组成,它们形成特定的模式,其中一些会激发宿主细胞的防御能力,另一些则有助于病毒感染的传播。
耶鲁大学的研究人员在分子生物物理学和生物化学教授Yong Xiong实验室的研究生Brady Summers的带领下,设计了一种方法来捕捉HIV-1病毒的单个蛋白模式,并揭示它们在感染期间的影响。Xiong说:"这些蛋白质片段就像乐高积木一样,是衣壳的基本组成部分,每一个都有不同的功能。例如,研究中的一个这样的片段使衣壳能够附着在细胞骨架上,在细胞内移动。了解每种模式的功能可以帮助研究人员增强引起宿主防御的相互作用的效果,或者阻止那些促进感染的相互作用。"
11.JCI:蛋白BRD4选择性的小分子可抑制HIV感染
doi:10.1172/JCI120633
在一项新的研究中,来自美国德克萨斯大学加尔维斯顿医学分部的研究人员发现了一种潜在药物作用于HIV感染者体内,从而进一步抑制这种一直存在但却悄无声息的病毒,而现有的HIV治疗方法无法对抗这种潜伏性的病毒。虽然这种潜在的新药可能补充当前的抗逆转录病毒治疗(ART)药物,但它也可能在不需要终生服用ART药物的情形下导致HIV缓解。相关研究结果近期发表在Journal of Clinical Investigation期刊上,论文标题为“Structure-guided drug design identifies a BRD4-selective small molecule that suppresses HIV”。
论文共同通讯作者、德克萨斯大学加尔维斯顿医学分部微生物学与免疫学系助理教授Haitao Hu说道,“我们在世界上首次证实人BRD4蛋白及其相关的复合物能够被用来抑制潜伏的HIV。我们的研究结果令人兴奋,这是因为它们不仅提高了我们对HIV表观遗传调控生物学的理解,而且它们还为开发沉默HIV的探针和/或治疗试剂提供一种有前景的方法,这最终有望导致人们治愈HIV感染。”
在这项实验室研究中,这些研究人员发现蛋白BRD4在调节HIV基因新拷贝的产生中起着重要作用。他们成功地设计、合成和评估了一系列小分子,以便选择性地对BRD4进行编程来抑制HIV,并且从中鉴定出一种称为ZL0580的先导化合物。他们在HIV感染模型中测试了这种先导化合物,并发现在接受ART药物治疗的HIV感染者的血细胞中,在ART药物停用后,它显著延迟了HIV重新激活。
12.Science子刊:重大进展!duoCAR-T细胞在确保不被HIV感染的同时高效抑制HIV
doi:10.1126/scitranslmed.aav5685
在一项新的研究中,来自美国生物技术公司Lentigen、阿尔伯特-爱因斯坦医学院、美国国家癌症研究所、阿拉巴马大学伯明翰分校、伯明翰退伍军人医疗中心和匹兹堡大学的研究人员发现他们构建的duoCAR-T细胞在人源化小鼠模型中有效地抵抗HIV。相关研究结果发表在2019年8月7日的Science Translational Medicine期刊上,论文标题为“Multispecific anti-HIV duoCAR-T cells display broad in vitro antiviral activity and potent in vivo elimination of HIV-infected cells in a humanized mouse model”。在这篇论文中,他们描述了如何构建duoCAR-T细胞以及它们如何很好地在人源化小鼠模型中发挥作用。

关于受HIV感染的T细胞的扫描电镜图,图片来自NIAID。
嵌合抗原受体(CAR)-T细胞(CAR-T)是对从患者体内取出的T细胞进行基因改造而获得新特性后产生的。在最近的一些病例中,它们发生改变的方式促使它们更有效地攻击癌细胞。这种技术涉及添加编码一种受体的基因,所编码的受体结合仅在癌细胞中发现的蛋白。几年前,一组研究人员在HIV感染者中尝试了这种技术。经证实,它在某些情况下是有效的,但是科学家们发现CAR-T细胞本身很容易被这种病毒感染。
在这项新的研究中,这些研究人员采用了一种更新的方法来使用CAR-T细胞来对抗HIV,让它们的CAR分子加倍。由此所获得的细胞被命名为duoCAR-T细胞。他们报道这种新方法的优势在于它靶向HIV包膜上的多个位点,而不是让T细胞发生改变后以CD4受体作为靶向位点。所使用的这两种特定的CAR分子是在开发40多种慢病毒载体并测试它们以观察哪种慢病毒载体是最有效的过程中发现的。
这些研究人员报道,在实验室测试时,他们的duoCAR-T细胞消除了大约99%的受感染的免疫细胞品系。当在人类小鼠模型上进行测试时,duoCAR-T细胞的剂量在治疗仅一周后能够抑制97%的HIV感染---远远优于传统的CAR-T细胞。他们还报道,duoCAR-T细胞经证实对HIV感染有抵抗力,这就克服了传统使用CAR-T细胞治疗HIV患者所面临的一个主要问题。最后,他们报道旨在测试这种新方法的有效性和安全性的临床试验计划最早在明年春天开始。
13.JAIDS:苯二氮卓类药物和肌肉松弛剂与HIV患者严重跌倒相关联
doi:10.1097/QAI.0000000000002130
在一项新的研究中,美国研究人员发现苯二氮卓类药物(benzodiazepines)和肌肉松弛剂与50多岁的HIV患者的严重跌倒有关。相关研究结果近期发表在Journal of Acquired Immune Deficiency Syndrome期刊上,论文标题为“Polypharmacy, hazardous alcohol and illicit substance use and serious falls among PLWH and uninfected comparators”。
美国弗吉尼亚州康涅狄格医疗系统的Julie A. Womack博士及其同事们研究了用药过多、有害酒精使用和违禁物使用与严重跌倒之间的关系是否因退伍军人老龄化队列研究(Veterans Aging Cohort Study)参与者的HIV状态而有所不同。有13530人经历过跌倒。根据年龄、种族、性别、HIV状况、观察时间和基线日期,这些病例与67060名对照者相匹配。
这些研究人员发现,在HIV感染者中,苯二氮卓类药物(比值比[OR] 1.24)和肌肉松弛剂(OR,1.29)与严重跌倒有关,但是他们在未感染者中并未观察到这一点。这两组人群发生跌倒的主要风险因素包括非抗逆转录病毒药物(五种药物中的每种; OR,1.20),违禁物使用/滥用(OR,1.44),有害酒精使用(OR,1.30)和阿片类药物处方(OR,1.35)。
14.eLife:研究发现新的抗病毒蛋白
doi:10.7554/eLife.46767
根据发表在《eLife》杂志上的新发现,一种名为KHNYN的新蛋白质已被确认为一种天然抗病毒系统中缺失的部分。研究人体对病毒的自然防御以及病毒如何进化以逃避抗病毒机制对于开发新的疫苗、药物和抗癌疗法至关重要。

图片来自CDC/C. Goldsmith, P. Feorino, E. L. Palmer, W. R. McManus. CC BY 0。
人类免疫缺陷病毒(HIV)通常不会受到ZAP的抑制,因为它已经进化到基因组中只有很少的CpG。然而,当CpGs被添加回病毒时,ZAP会促进其破坏。这有助于我们理解为什么拥有更多CpG的艾滋病毒繁殖不那么成功,并可能解释为什么许多艾滋病毒菌株进化成拥有较少CpG的。但是一个谜团仍然存在,因为ZAP无法单独分解病毒RNA。
"由于ZAP本身不能降解RNA,我们认为它必须招募其他蛋白质到病毒RNA中来破坏它,"首席作者Mattia Ficarelli说,她是伦敦国王学院传染病系Chad Swanson实验室的博士生。"因此,在目前的研究中,我们开始鉴定新的人类蛋白质,这些蛋白质对于ZAP以病毒RNA为靶点进行破坏至关重要。"
在发现KHNYN与ZAP相互作用后,研究小组测试了当他们增加细胞中产生的KHNYN的数量时所发生的情况。细胞中KHNYN产量的增加使典型HIV的增殖能力降低了约为5倍,并降低了富含CpG的HIV的增殖能力约为400倍。
为了弄清楚KHNYN和ZAP是否协同工作,研究小组在没有ZAP的细胞中重复了同样的实验,并发现KHNYN并不会抑制富含CpG的HIV的增殖能力。然后他们观察了基因工程细胞中缺少KHNYN的情况,发现富含CpG的HIV和含有许多CpG的小鼠白血病病毒都不再受到ZAP的抑制。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


