丛集性头痛,不是吃颗止痛药那么简单!
张先生今年24岁,正值风华正茂,但多年的头痛,让他的脸上少了几分同龄人的朝气。噩梦从10年前的初中开始,还记得当时突然有一阵前所未有的头痛,眼睛红肿,随之而来的是一侧额头和太阳穴阵阵剧痛,像小虫子在大脑中游走,搅拌,又像“霹雳”一样,头痛欲裂,不仅如此,在整个过程中还伴随着眼睛充血、流眼泪以及痛的一侧鼻塞等症状。 从那以后,这个头痛就像是上了“闹钟”一样,每天1-2次,到了时间点就“如约而至”,而
抗NGF类止痛药前景堪忧!辉瑞/礼来公布骨关节炎3期临床结果
辉瑞与合作伙伴礼来近日公布了非阿片类新型止痛药tanezumab治疗骨关节炎(OA)III期临床研究(A4091058)的顶线结果。该研究旨在比较两种剂量tanezumab(2.5mg和5mg)与非甾体抗炎药(NSAID)治疗中度至重度髋关节或膝关节OA患者56周的疗效和长期(80周)安全性。结果显示,仅高剂量tanezumab表现出显着疗效,但同时关节安全事件发生率明显升高。A409
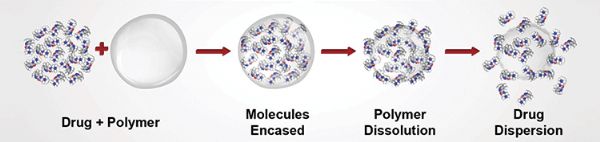
术后止痛新药!Heron公司新型非阿片类止痛药HTX-011(布比卡因/美洛昔康)在欧盟进入审查
2019年4月08日讯 /生物谷BIOON/ --Heron Therapeutics是一家商业化阶段的生物技术公司,专注于开发同类最佳的药物,以满足一些最重要的未满足医疗需求。近日,该公司宣布,欧洲药品管理局(EMA)已受理术后疼痛药物HTX-011的上市许可申请(MAA),并将进行集中审查。欧盟委员会(EC)预计将在2020年上半年做出最终审查决定。在美国,FDA于已2018年12月底受理了H
新型止痛药!辉瑞/礼来NGF抑制剂tanezumab治疗骨关节炎(OA)III期临床曝出长期关节安全问题
2019年4月21日讯 /生物谷BIOON/ --美国制药巨头辉瑞(Pfizer)与礼来(Eli Lilly)近日公布了评估tanezumab治疗骨关节炎(OA)患者的长期III期研究(A4091058)的顶线结果。该研究在中度至重度髋关节或膝关节OA患者中开展,评估了2种剂量(2.5mg和5mg)相对于非甾体抗炎药(NSAID)的长期关节安全性和16周疗效。结果显示,5mg剂量tanezumab
辉瑞最畅销止痛药Lyrica致多人死亡 英国将其重归C类受控药
在辉瑞公司的Lyrica(pregabalin,普瑞巴林)导致了北爱尔兰数十人死亡后,处方药普瑞巴林将从4月1日起在英国被重新归类为C类受控药物。这意味着在没有处方的情况下拥有普瑞巴林是非法的,非法拥有该药物的最高刑罚是两年监禁。如果相关机构擅自销售或供应该药物,将会被判处14年有期徒刑。普瑞巴林由辉瑞销售,是全球最畅销的镇痛药,2017年销售额为51亿美元,其中美国市场销售额为34.6亿美元。L
非阿片类止痛药!Recro公司静脉注射meloxicam治疗中重度疼痛遭美国FDA第二次拒绝
2019年03月24日讯 /生物谷BIOON/ --Recro制药公司近日宣布,已收到美国食品和药物管理局(FDA)药物评估办公室关于其新药申请(NDA)的第二封完整回应函(CRL),该NDA申请批准静脉注射Meloxicam(30mg)用于中度至重度疼痛的治疗。目前,疼痛市场市值59亿美元,由阿片类药物主导。Meloxicam IV属于非阿片类药物,据认为可以克服常规处方阿片类药物的许多相关问题
Sci Adv:研究发现更长效且不上瘾的纳米止痛药
2019年2月15日讯 /生物谷BIOON /——一组来自巴黎萨克莱大学和巴黎笛卡尔大学的研究人员已经开发出了一种纳米药物可以缓解啮齿类动物的疼痛。在他们最新发表在《Science Advances》上的研究中,研究人员报告了他们的这种纳米药物效果更持久,而且比阿片类药物更不容易让人上瘾。图片来源:Science Advances阿片类药物可以有效止痛,因此在全球广泛用于缓解疼痛。但是正如广泛报道
新型止痛药!辉瑞/礼来NGF抑制剂tanezumab治疗慢性下腰痛(CLBP)III期临床成功
2019年2月20日讯 /生物谷BIOON/ --美国制药巨头辉瑞(Pfizer)与礼来(Eli Lilly)近日公布了评估tanezumab治疗中度至重度慢性下腰痛(CLBP)的III期临床研究积极数据。结果显示,在治疗第16周,与安慰剂组相比,10mg剂量tanezumab治疗组疼痛表现出统计学意义的显著改善,达到了研究的主要终点。然而,在第16周分析中,与安慰剂组相比,5mg剂量tanezu
术后止痛新药!新型非阿片类止痛药HTX-011获美国FDA受理并授予优先审查资格
2019年1月9日讯 /生物谷BIOON/ --Heron Therapeutics是一家商业化阶段的生物技术公司,专注于开发同类最佳的药物,以满足一些最重要的未满足医疗需求。近日,该公司宣布,美国食品和药物管理局(FDA)已受理HTX-011的新药申请(NDA)并授予了优先审查资格(PRD),处方药用户收费法(PDUFA)目标日期为2019年4月30日。之前,FDA还授予了HTX-011快速通道
创新止痛药HTX-011获FDA优先审评资格
日前,总部位于美国加州圣地亚哥的生物技术公司Heron Therapeutics宣布FDA已经接受其非阿片类在研止痛药HTX-011的新药申请(NDA),并颁发了优先评审资格。这一申请有望在2019年4月30日前得到批复。使用阿片类止痛药急性控制术后疼痛,与每年超过200万新的阿片类药物持续使用者直接相关。术后阿片类药物使用成为美国阿片类药物滥用的一个重要诱因。每年有超过10亿片阿片类