泛因医学研发的新型冠状病毒特异性T细胞检测试剂获欧盟CE准入资质
近日,泛因医学研发的新型冠状病毒特异性T细胞检测试剂获欧盟CE准入资质。该试剂盒的灵敏度为91.03%,特异性为93.18%,能显著提高检测的准确性。
罗氏诊断与九强生物共同推出全新二代生化试剂盒,打造外诊断领域全新格局
强强联合,共同推出全新的二代生化试剂盒,并通过整合双方的技术、资源优势,持续推进本土创新,以期打造中国体外诊断市场的全新格局。
国家药监局发布《体外诊断试剂分类规则》
10月29日,为规范体外诊断试剂分类管理,根据《医疗器械监督管理条例》,国家药监局组织制定了《体外诊断试剂分类规则》,自发布之日起施行。一、起草背景我国医疗器械(含体外诊断试剂)分类实行分类规则指导下的分类目录制,分类规则和分类目录并存,以分类目录优先。与《医疗器械分类规则》不同,此前我局并未将体外诊断试剂分类规则作为单独的文件发布,而是将有关内容先后写入了
山东新冠抗体检测试剂盒取得医疗器械注册证
近日,山东省生物诊断技术创新中心的科技创新成果——新型冠状病毒(2019-nCoV)IgM/IgG抗体检测试剂盒(胶体金法)取得国家药品监督管理局颁发的医疗器械注册证。作为山东省首批试点的五家技术创新中心之一,山东省生物诊断技术创新中心此次获批的新型冠状病毒(2019-nCoV)IgM/IgG抗体检测试剂盒(胶体金法),由
基石药业联合泛生子合作开发的泰吉华®伴随诊断试剂盒获NMPA优先审批
日前,基石药业(香港联交所代码:2616)的合作伙伴泛生子(纳斯达克代码:GTH)宣布,其联合基石药业开发的泰吉华®伴随诊断试剂盒——人PDGFRA基因D842V突变检测试剂盒(PCR-荧光探针法)获国家药品监督管理局(NMPA)优先审批,成为首个进入优先审批程序的国产伴随诊断试剂盒。 据了解,《医疗器械优先审批程序》旨在对符合条件的境内
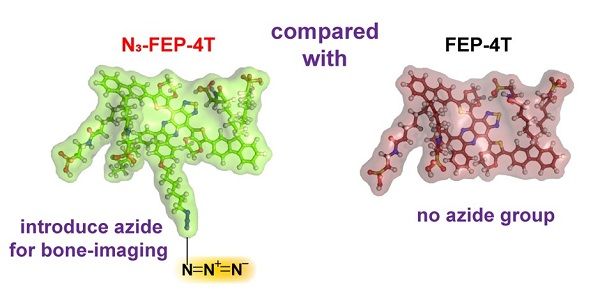
Journal of Medicinal Chemistry:开发出基于叠氮骨靶向的小分子近红外二区荧光骨质疏松诊断试剂
骨质疏松是威胁老年人身心健康的常见疾病,该病发病率高且有较为严重的并发症。骨折是经常发生、危害较大的并发,因此,尽早准确诊断以及长期有效监测骨质疏松,对预防骨折等相关并发症十分重要。临床上常用的骨骼疾病影像技术包括X射线,CT、MRI、SPECT/CT及PET/CT。这些成像手段由于潜在的电离辐射危害、价格高昂及低时空分辨率等缺点,无
国家药监局发布基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查等5项注册技术审查指导原则的通告
近日,为加强医疗器械产品注册工作的监督和指导,国家药监局官网发布基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查等5项注册技术审查指导原则的通告。原文如下:为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药品监督管理局组织制定了《基于同类治疗药物的肿瘤伴随诊断试剂说明书更新与技术审查指导原则》《实时荧光PCR
港交所基因测序第一股贝康医疗上市,开启中国三代试管婴儿试剂盒“有证”时代
2021年02月08日,中国辅助生殖基因检测创新企业贝康医疗(苏州贝康医疗股份有限公司)在香港联交所主板正式挂牌上市,股票代码:2170。超额配售权行使前发行约6,666.7万股,募集资金总额约18.2亿港元,发售价为每股27.36港元,超额认购达402.8倍,截至发稿为止涨幅17.14%,总市值达84.14亿港元。此次上市是贝康医疗发展史上的一个重要里程碑
金斯瑞新冠中和抗体检测试剂盒在美获授权用于恢复期血浆筛查,有助于提高恢复期血浆治疗的有效性
全球领先的生物科技公司金斯瑞生物(股票代码HK01548)于近日宣布,全球第一款能够快速有效检测功能性中和抗体的试剂盒cPass已获美国食品药品监督管理局 (FDA)生物制品评估与研究中心(CBER)授权用于恢复期血浆筛查,是FDA授权的首个能在不使用活病毒的情况下专门检测COVID-19中和抗体的检测试剂。COVID-1
珀金埃尔默推出首个细胞全景绘制即用试剂系列
致力于以创新打造更健康世界的技术型企业珀金埃尔默,最新推出首个细胞全景绘制即用试剂盒PhenoVue™,并与其全新的细胞成像试剂系列产品进行全球同步发布。细胞成像新试剂系列全面匹配珀金埃尔默成像微孔板、全自动细胞样品准备系统、高内涵成像系统和大数据智能分析技术,共同组成了针对小分子、siRNA、CRISPR、天然产物库等药物筛选的即用型高通量解决