第一三共新型口服CSF1R抑制剂pexidartinib获美国FDA优先审查
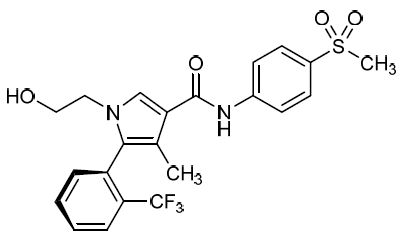
2019年2月14日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)近日宣布,美国食品和药物管理局(FDA)已受理pexidartinib的新药申请(NDA)并授予了优先审查资格(PRD),该NDA申请批准pexidartinib用于存在严重的发病率或功能限制且不适合手术改善的有症状腱鞘巨细胞瘤(TGCT)成人患者的治疗。FDA已指定处方药用户收费法(PDUFA)目标
第一三共Tarlige(mirogabalin)获批治疗周围神经病理性疼痛(PNP)
2019年1月17日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)近日宣布,Tarlige(mirogabalin besylate)2.5mg、5mg、10mg、15mg片剂已获日本批准,用于周围神经病理性疼痛(PNP)的治疗。一般情况下,成人患者的初始剂量为5mg,每日口服2次,之后以至少一周的间隔逐渐增加5mg,直至15mg。剂量可根据年龄和症状在10mg和1
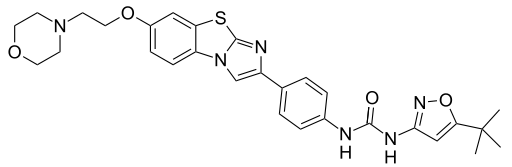
第一三共新型抗癌药DS-8201治疗HER2低表达乳腺癌进入关键性全球III期临床
2019年1月24日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)近日宣布,评估新型靶向抗癌药(ADC)DS-8201(trastuzumab deruxtecan)治疗HER2低表达乳腺癌的关键性全球III期临床研究DESTINY-Breast04,首例患者已接受了治疗。HER2低表达乳腺癌约占所有乳腺癌病例的40%。目前,还没有抗HER2疗法获批用于HER2低表
第一三共盐皮质激素受体激活抑制剂Minnebro(esaxerenone)获批
2019年1月14日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)近日宣布,Minnebro(esaxerenone)1.25mg、2.5mg、5mg片剂获得日本监管机构批准,用于治疗高血压。盐皮质激素受体(MR)的过度激活与高血压有关,Minnebro被认为通过选择性阻断这些受体的激活发挥抗高血压作用。第一三共预计,Minnebro将为日本的患者和医疗保健专业人员
第一三共与Esperion签署9亿美元协议,获bempedoic acid欧洲权益
2019年1月14日讯 /生物谷BIOON/ --日本药企第一三共欧洲子公司Daiichi Sankyo Europe近日宣布与美国生物制药公司Esperion Therapeutics签订了一项独家许可协议,允许Daiichi Sankyo Europe在欧洲经济区和瑞士销售降胆固醇新药bempedoic acid以及bempedoic acid/伊折麦布(ezetimibe)复方片。Daiic
第一三共/三菱UFJ/东京工业大学合作利用iPSC创造胰腺β细胞
2019年1月14日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)、三菱UFJ资本有限公司、东京工业大学(Tokyo Institute of Technology)近日联合宣布,将启动开放式创新研究,目的是用诱导性多能干细胞(iPSC)创造胰岛素生成细胞,用于再生医学和细胞治疗。东京工业大学生命科学与技术学院Kume和Shiraki实验室已经开发出了一种技术,能够
第一三共新型ADC药物DS-8201在HER2低表达乳腺癌患者中表现出强劲疗效
2018年12月12日讯 /生物谷BIOON/ --日本药企第一三共(Daiichi Sankyo)近日公布了有关实验性HER2靶向性抗体药物偶联物(ADC)DS-8201(trastuzumab deruxtecan)的一项正在进行的I期临床研究的最新安全性和有效性数据。该研究中,共有54例过度治疗(之前已接受的抗癌方案的中位数为7.5种)的HER2低表达乳腺癌患者接受了至少1次DS-8201(
第一三共第2代FLT3抑制剂quizartinib斩获美国FDA的优先审查资格
2018年11月23日讯 /生物谷BIOON/ --日本药企第一三共制药(Daiichi Sankyo)近日宣布,美国食品和药物管理局(FDA)已受理靶向抗癌药quizartinib治疗复发性/难治性FLT3-ITD急性髓性白血病(AML)成人患者的新药申请(NDA)并授予了优先审查资格(PRD),其审查周期将由常规的10个月缩短至6个月,并预计在2019年5月25日作出审查决定。PRD是FDA创
第一三共FLT3抑制剂quizartinib获欧盟EMA加速评估
2018年11月06日讯 /生物谷BIOON/ --日本药企第一三共制药(Daiichi Sankyo)近日宣布,欧洲药品管理局(EMA)已受理靶向抗癌药quizartinib治疗复发性/难治性FLT3-ITD急性髓性白血病(AML)成人患者的上市许可申请(MAA)并授予了加速评估资格。EMA人用医药产品委员会(CHMP)将开始对quizartinib的MAA进行科学审查。而加速评估资格,意味着q
第一三共CAR-T细胞疗法Yescarta在日本被授予治疗4种淋巴瘤的孤儿药资格
2018年10月07日讯 /生物谷BIOON/ --日本药企第一三共制药(Daiichi Sankyo)近日宣布,日本卫生劳动福利部(MHLW)已授予CAR-T细胞疗法axicabtagene ciloleucel(前称KTE-C19)治疗弥漫性大B细胞淋巴瘤(DLBCL)、原发性纵膈(胸腺)大B细胞淋巴瘤(PMBCL)、高级别B细胞淋巴瘤(HGBL)、转化滤泡性淋巴瘤(TFL)的孤儿药资格,上述