Eiger公司首创法尼基转移酶抑制剂lonafarnib获美国FDA突破性药物资格
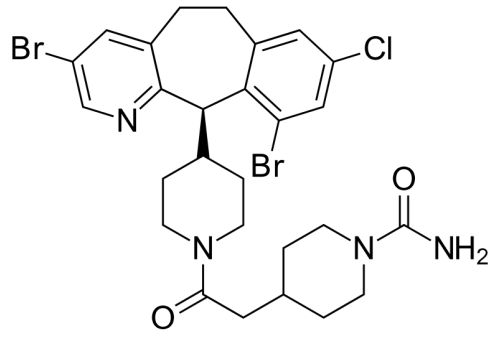
2018年12月19日/生物谷BIOON/--Eiger是一家后期临床阶段的生物制药公司,致力于加速开发和商业化一系列靶向性、首创性的疗法,用于罕见病和超罕见病的治疗。近日,该公司宣布,美国食品和药物管理局(FDA)已授予lonafarnib治疗丁型肝炎病毒(HDV)感染的突破性药物资格(BTD)。HDV是最严重类型的人类病毒学肝炎,目前尚无获批的治疗药物。lonafarnib是一种首创的异戊二烯
新型药物制剂有望延长人类寿命!
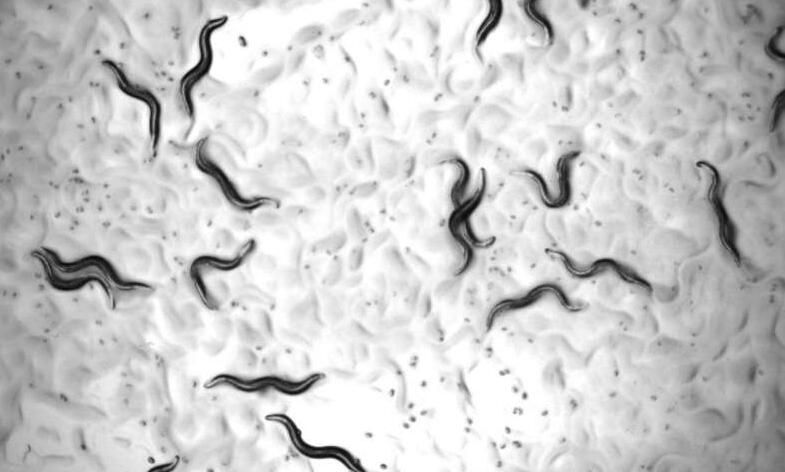
2018年11月2日 讯 /生物谷BIOON/ --日前,一项刊登在国际杂志Developmental Cell上的研究报告中,来自耶鲁-新加坡国立大学学院的研究人员通过研究发现,一种新型的药物组合不仅能够增加秀丽隐杆线虫的健康寿命,还能够减缓其老化的速度,相关研究结果或为研究人员开发在哺乳动物机体中能产生类似效应的药物组合或疗法奠定了基础。图片来源:Dr Jan Gruber.研究者Jan Gr
Loxo选择性RET激酶抑制剂获突破性药物资格
Loxo Oncology是一家专注于开发高度选择性小分子靶向药物用于治疗由基因组学定义的癌症/肿瘤的临床阶段生物制药公司。近日,该公司宣布,美国食品和药物管理局(FDA)已授予选择性RET抑制剂LOXO-292治疗两种类型癌症的突破性药物资格(BTD)*,具体为:1)接受含铂化疗以及一种PD-1或PD-L1肿瘤免疫疗法治疗后病情进展、需要系统治疗(全身治疗)的转移性转染期
首个卵巢癌靶向药物利普卓®在中国获批,卵巢癌治疗进入PARP抑制剂时代
近日,阿斯利康中国与默沙东中国联合宣布,中国国家药品监督管理局(CNDA)已批准首个PARP抑制剂—利普卓®(奥拉帕利片剂)用于铂敏感复发性卵巢癌的维持治疗。自今年政府工作报告之后,几乎每个月都有重磅肿瘤产品获批,此次奥拉帕利在中国的获批,再次印证国家加速审批临床急需新药、及早惠及国内患者的决心和行动力。中国工程院院士、中华医学会妇科肿瘤学会分主任委员马丁教授介绍:“卵巢癌在过去的30年
安进降胆固醇药物PCSK9抑制剂瑞百安®在华获批
为纯合子型家族性高胆固醇血症患者提供创新治疗方案2018年8月8日,中国上海——今日,安进中国宣布,瑞百安®(英文名Repatha®,通用名 依洛尤单抗evolocumab)注射液已于7月31日获得国家药品监督管理局(原国家食品药品监督管理总局)批准,成为首个在中国获批用于治疗成人或12岁以上青少年纯合子型家族性高胆固醇血症(HoFH)的PCSK9抑制剂。前蛋白转化酶枯草溶菌素
Cancer Res:新型药物混合制剂不仅能增强癌症靶向性疗法的效率 还能降低疗法副作用
2018年8月2日 讯 /生物谷BIOON/ --近日,一项刊登在国际杂志Cancer Research上的一篇研究报告中,来自西奈山医学院的科学家们通过研究发现,一种特殊的药物混合制剂或能帮助靶向疗法高效攻击癌细胞,同时还会减轻疗法所带来的副作用。图片来源:hmcisrael.com这种新型药物混合制剂能通过多角度抑制癌细胞生长,从而帮助减缓癌细胞对药物所产生的耐受性,这种混合制剂包括化疗、抗肿
全球首例 卫材胆汁酸转运抑制剂便秘药物GOOFICE在日本上市
日前,日本制药名企卫材公司旗下胃肠疾病子公司EA药业和Mochida制药股份有限公司宣布,全球首款胆汁酸转运抑制剂于2018年4月19日正式在日本上市。该药物商品名为GOOFICE(通用名elobixibat hydrate),剂型为片剂,药物含量为5mg/片,药品的开发编号AJG533。EA药业是通过向Albireo AB(瑞典)获得了该药物的许可。GOOFICE片剂是一
2017年(第11届)中国药物制剂大会成功召开
10月28日,由中国药学会主办,中国药学会药剂专业委员会、中国药学会纳米药物专业委员会、国际控释协会中国分会、中国医药工业研究总院、复旦大学药学院、药物制剂国家工程研究中心、中国医药工业信息中心、上海市药学会承办的2017年(第11届)中国药物制剂大会在上海隆重召开。国家食品药品监督管理总局副局长、中国药学会理事长孙咸泽出席会议并致辞,他表示,习总书记要求加快建设创新型国家,本次会议以“能级提升—
亚盛医药新靶点IAP抑制剂抗肿瘤药物APG-1387 获美国FDA临床试验批准
美国马里兰州罗克维尔市,2017年11月13日-中国领先的原创新药研发公司亚盛医药今日宣布,公司日前收到美国FDA关于同意APG-1387用于治疗晚期实体瘤、恶性血液肿瘤进行临床试验的函,为亚盛团队第3个一次性30日通过FDA的IND审批品种。目前公司有4个品种在美国开展临床I-II期试验。APG-1387是亚盛医药自主设计开发的、具有全球知识产权的新一代凋亡蛋白抑制因子(IAP)高效特异性抑制剂
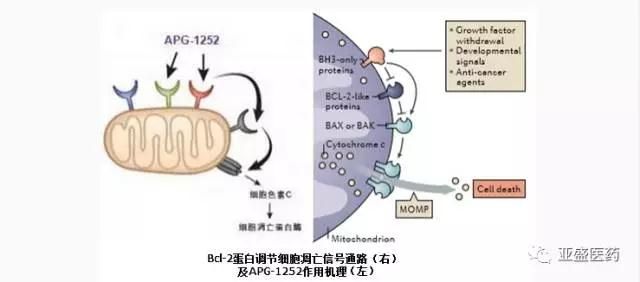
亚盛医药原创新靶点抗肿瘤药物Bcl-2/Bcl-XL抑制剂 APG-1252获CFDA临床批件
2017年6月26日--亚盛医药今日宣布,由企业自主设计开发的、具有全球知识产权的、特异性诱导细胞凋亡类抗肿瘤1类新药APG-1252获得国家食品药品监督管理总局(CFDA)的临床批准,该品种于2016年12月正式进入CDE技术审评程序,仅用时不到6个月就完成所有技术审评并获取临床批件。APG-1252通过选择性抑制Bcl-2蛋白家族成员Bcl-2及Bcl-XL来恢复肿瘤细胞程序性死亡机制(细胞凋