FDA发布3D打印医疗器械制造指导意见
2017年12月5日,美国食品和药物管理局 (FDA)发布3D打印医疗器械制造指导意见,为医疗设备制造商提供有关3D打印技术方面的建议,同时还指出制造商在提交3D打印医疗设备审批时需包含的内容,包括对各种3D打印方法的思考、设备设计、功能、耐用性测试以及质量系统要求。无疑,FDA的这一举措将促进3D医疗打印设备行业进一步发展。去年5月,FDA发布了针对医疗制造商的3D打印草案指南,允许
2018年医疗器械12大发展趋势预测
2017年即将过去,回望过去看未来,2018年的医疗器械政策层面,将会有怎样一番新景象呢?笔者试分析如下,欢迎拍砖。1、医疗器械上市许可持有人制度或将出台今年10月底的《医疗器械监督管理条例修正案(草案征求意见稿)》,已经提到要完善这一制度,设专条规定注册人和备案人的条件以及应当履行的具体义务,上海方面已经在推行试点,在药品方面,相似法规则已经出台。这个政策将让个人拥有医疗器械注册证,“有厂才能有
FDA批准Apple Watch上首款医疗器械
昨日,AliveCor公司宣布该公司为苹果手表设计的KardiaBand医疗器械附件获得FDA批准。AliveCor公司是一家专精于个人心电图(electrocardiogram,EKG)技术的公司。KardiaBand能够让苹果手表用户在任何地方,任何时候记录自己的EKG并且可以分辨正常窦性心律和心房颤动(atrial fibrillation,AFib)。用户只需要点击Kardia
发改委:未来3年重点支持这些医疗器械
最新消息,国家发改委制定并印发了《增强制造业核心竞争力三年行动计划(2018-2020年)》。该行动计划提出,到“十三五”末,制造业重点领域要突破一批重大关键技术实现产业化,形成一批具有国际影响力的领军企业,打造一批中国制造的知名品牌,创建一批国际公认的中国标准,制造业创新能力明显提升、产品质量大幅提高、综合素质显着增强。该行动计划一共提出了9个要聚焦增强核心竞争力的制造业重点领域,“
总局抽检:又有11款医疗器械不合格
11月27日,CFDA发布了《国家医疗器械质量公告(2017年第26期,总第44期)》,又有11款医疗器械产品不符合标准规定。此次被抽检项目不符合标准规定的医疗器械产品,涉及8家企业的3个品种11批(台)。具体为:一次性使用无菌阴道扩张器5家企业6批次产品。新乡市康民卫材开发有限公司生产的1批次一次性使用无菌阴道扩张器,结构强度、环氧乙烷残留量不符合标准规定;南昌卫材医疗器械有限公司生
第三届医疗器械创新发展与临床注册高峰论坛
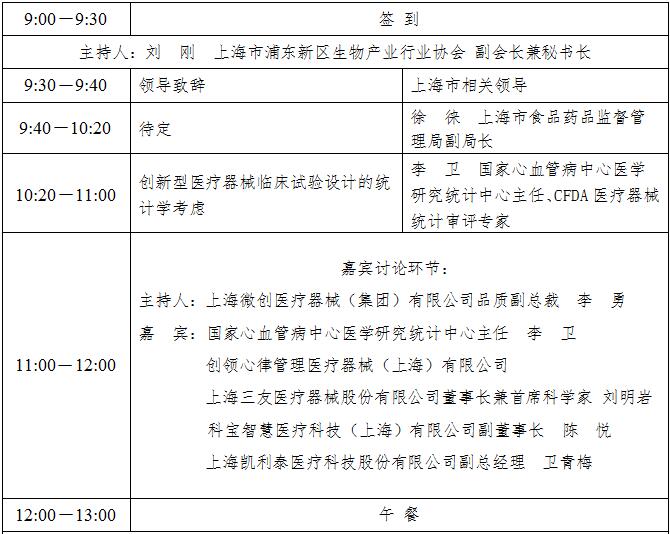
自2015年8月《国务院关于改革药品医疗器械审评审批制度的意见》以来,CFDA密集发布了规范药物、医疗器械临床试验相关的文件。10月8日,中共中央办公厅和国务院办公厅联合印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》。这又是一个深化药品医疗器械审评审批制度改革的纲领性文件,对我国医药产业创新发展具有里程碑意义。中国医疗器械研发领域将迎来崭新的时代。为此,上海市浦东新区生物产业行业协会将
总局办公厅关于加强互联网药品医疗器械交易监管工作的通知
各省、自治区、直辖市食品药品监督管理局,新疆生产建设兵团食品药品监督管理局:为贯彻落实《国务院关于取消一批行政许可事项的决定》(国发〔2017〕46号)的要求,做好相关事中事后监管措施的衔接工作,现就加强互联网药品、医疗器械交易监管工作有关事项通知如下:一、落实监管责任。建立完善互联网药品、医疗器械交易服务企业(第三方)监管制度,按照“线上线下一致”原则,规范互联网药品、医疗器械交易行为。各地应按
《医疗器械监督管理条例》修改19条 完善上市许可持有人制度
国家食品药品监管总局(CFDA)公开征求《〈医疗器械监督管理条例〉修正案(草案征求意见稿)》意见。请社会各界紧紧围绕,中共中央办公厅、国务院办公厅于10月1日印发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》提出的改革措施,提出意见和建议,请将意见和建议通过电子邮件的形式于2017年11月12日前反馈食品药品监管总局法制司(联系邮箱:xuxy@CFDA.gov.c
CFDA注销24款医疗器械
10月17日,又有4款医疗器械被CFDA注销注册证。CFDA发布“第120号”公告称,按照《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)第六十五条的规定,根据企业申请,现注销上海微创骨科医疗科技有限公司等3家企业以下4个产品的医疗器械注册证书。第120号公告注销4个医疗器械注册证一、上海微创骨科医疗科技有限公司的2个产品:椎间融合器,注册证号:国械注准2015346039
关于深化审评审批制度改革鼓励药品医疗器械创新的意见
近日,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,并发出通知,要求各地区各部门结合实际认真贯彻落实。 《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》全文如下。 当前,我国药品医疗器械产业快速发展,创新创业方兴未艾,审评审批制度改革持续推进。但总体上看,我国药品医疗器械科技创新支撑不够,上市产品质量与国际先进水平存在差距。为促进药品医疗器械产