NEJM:临床试验表明巴瑞替尼和瑞德西韦的组合使用有望治疗新冠肺炎
2020年12月13日讯/生物谷BIOON/---根据一项新的临床试验的结果,抗炎药巴瑞替尼(baricitinib)和抗病毒药瑞德西韦(remdesivir)的联合使用,可以减少COVID-19住院患者的康复时间。该临床研究得到了美国国家卫生研究院(NIH)下属的国家过敏与传染病研究所(NIAID)的支持。相关研究结果于2020年12月11日在线发表在Ne
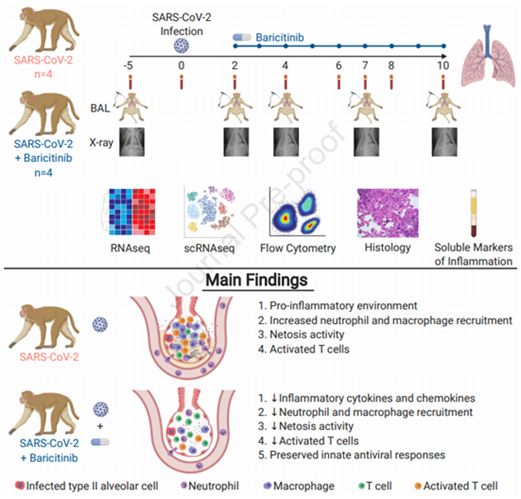
Cell:巴瑞替尼可降低新冠病毒感染的恒河猴中的炎症
2020年11月12日讯/生物谷BIOON/---SARS-CoV-2诱导的高细胞因子血症(hypercytokinemia)和炎症与COVID-19的疾病严重程度密切相关。作为一种临床批准的JAK1/2抑制剂,巴瑞替尼(baricitinib)目前正在COVID-19临床试验中进行研究。在一项新的研究中,来自美国埃默里大学的研究人员研究了巴瑞替尼在SARS
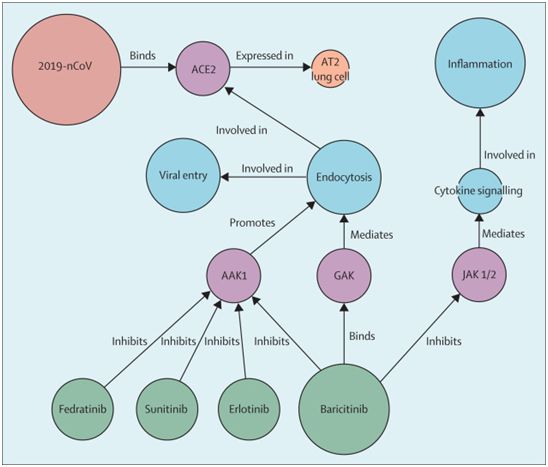
Lancet:巴瑞替尼可能用于治疗2019-nCoV急性呼吸道疾病
2020年2月12日讯/生物谷BIOON/---鉴于2019年新型冠状病毒(2019-nCoV)急性呼吸道疾病的规模和迅速传播,在疫苗生产出来之前迫切需要能够起作用的药物。对2019-nCoV的快速测序结果再结合对基于相关病毒基因组的分子建模提示着一些化合物可能是有效的,包括抗HIV的洛匹那韦(lopinavir)和利托那韦(ritonavir)药物联用。B
Lenvima(乐伐替尼)联合依维莫司治疗非透明细胞肾细胞癌(nccRCC)临床受益率61.3%!
2020年02月16日讯 /生物谷BIOON/ --日本药企卫材(Eisai)近日在旧金山举行的2020年美国临床肿瘤学会泌尿生殖系统癌症研讨会(ASCO-GU 2020)上公布了抗癌药Lenvima(乐卫玛®,通用名:lenvatinib,仑伐替尼)联合依维莫司(everolimus)(以下简写为“LEN+EVE方案”)治疗不可切除性晚期或转移性
礼来类风湿关节炎新药艾乐明®(巴瑞替尼片)在中国获批
7月1日,礼来中国宣布,国家药品监督管理局(NMPA)批准了艾乐明®(巴瑞替尼片)2mg片剂用于治疗成人中重度活动性类风湿关节炎。艾乐明®(巴瑞替尼片)是一种酪氨酸蛋白激酶(JAK)1/2抑制剂,每天一次口服给药1。艾乐明®(巴瑞替尼片)适用于对一种或多种改善病情抗风湿药(DMARD)疗效不佳或不耐受的中重度活动性类风湿关节炎成年患者,可以与甲氨蝶呤或其他非生物改善病
百特即用型柔性容器预混eptifibatide(依替巴肽)获美国FDA批准
2019年03月12日/生物谷BIOON/--百特国际(Baxter International)近日宣布,美国食品和药物管理局(FDA)已批准即用型eptifibatide(依替巴肽),这是首个也是唯一一个以柔性容器呈现的预混依替巴肽产品。依替巴肽是百特广泛的即用型药物中的最新产品,旨在帮助提高患者安全性和支持药房效率,百特已将该产品立即推向美国市场。百特制药公司总裁Robert Felicel
依鲁替尼+奥妥珠单抗缓解率89%
强生旗下公司杨森制药近日宣布,美国FDA批准IMBRUVICA?(依鲁替尼)联合obinutuzumab(奥妥珠单抗)用于慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)的初治患者,CLL/SLL是成人中白血病最常见的形式。这是首个批准用于CLL/SLL初治患者的非化疗联合疗法,标志着IMBRUVICA自2013年11月在美国批准上市以来的第10次获得FDA批准。该批准扩大了IM
依鲁替尼+奥妥珠单抗缓解率89%
强生旗下公司杨森制药今日宣布,美国FDA批准IMBRUVICA?(依鲁替尼)联合obinutuzumab(奥妥珠单抗)用于慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)的初治患者,CLL/SLL是成人中白血病最常见的形式。这是首个批准用于CLL/SLL初治患者的非化疗联合疗法,标志着IMBRUVICA自2013年11月在美国批准上市以来的第10次获得FDA批准。该批准扩大了IM
NEJM:药物依鲁替尼或能有效治疗慢性淋巴细胞白血病
2019年1月14日 讯 /生物谷BIOON/ --近日,一项刊登在国际杂志New England Journal of Medicine上的研究报告中,来自洛约拉大学卫生系统的科学家们通过研究发现了一种新型的靶向药物,相比标准疗法而言,其能更加有效地治疗慢性淋巴细胞白血病(CLL)老年患者。图片来源:en.wikipedia.org这种名为依鲁替尼(ibrutinib)的药物能有效攻击癌细胞,同
Shire公司Gattex(替度鲁肽)治疗儿科适应症在美国进入正式审查
2018年11月14日讯 /生物谷BIOON/ --英国制药公司Shire近日宣布,美国食品和药物管理局(FDA)已受理Gattex(替度鲁肽,teduglutide)的补充新药申请(sNDA)。该sNDA申请批准扩大Gattex注射液的适应症,用于依赖肠外支持的短肠综合征(SBS)儿科患者(1-17岁)的治疗。FDA预计将在2019年3月份作出审查决定。Gattex是一种处方药,之前已获FDA批