膀胱癌ADC疗法上市申请获FDA优先审评!齐鲁制药3500万美元引进中国权益
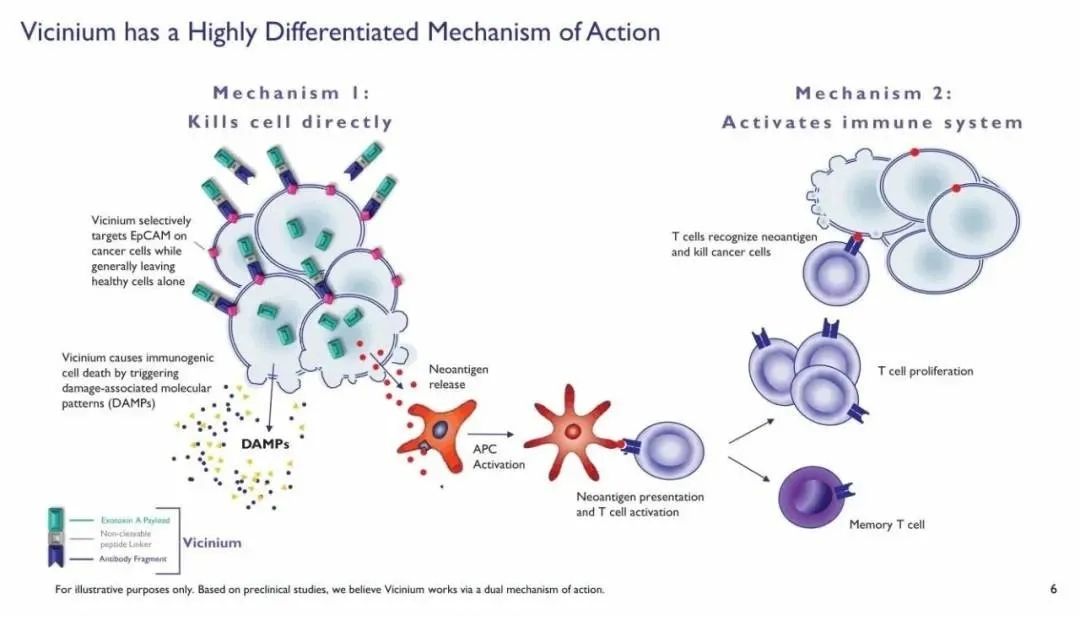
Sesen Bio宣布FDA已经受理其创新ADC药物Vicineum(oportuzumab monatox )治疗对卡介苗(BCG)无应答的高风险非肌层浸润性膀胱癌(NMIBC)患者的上市申请,并授予优先审评资格,PDUFA预定审批期限是2021年8月18日。Vicineum是由可以靶向上皮细胞黏附分子(EpCAM)的重组融合蛋白o
百时美施贵宝血液病创新药Luspatercept上市申请获CDE优先审评
2021年2月4日,百时美施贵宝中国宣布,其红细胞成熟剂Luspatercept(英文商品名Reblozyl;自拟中文通用名:注射用罗特西普;自拟中文商品名:利布洛泽)的上市申请已获国家药品监督管理局药品审评中心(CDE)正式受理并被授予优先审评资格,用于需要定期输注红细胞(RBC)的成人β-地中海贫血患者。
奥拉帕利新适应症上市申请拟纳入优先审评 治疗前列腺癌
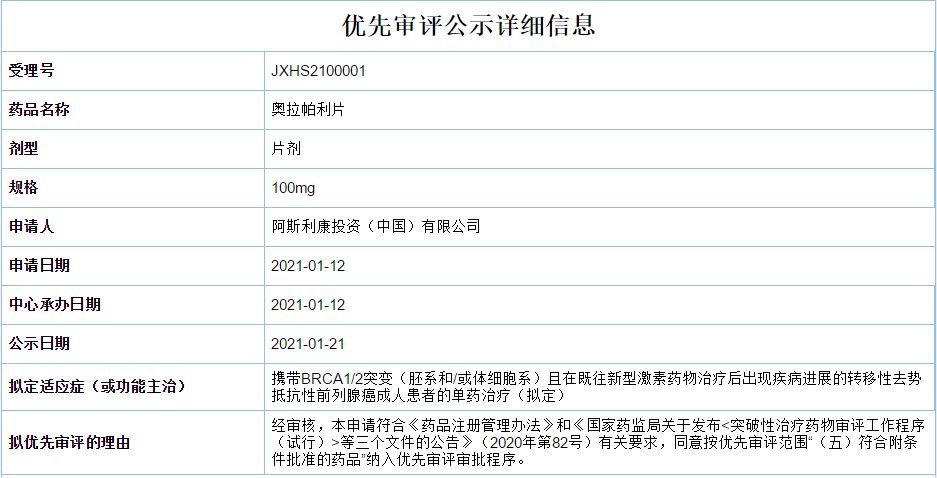
CDE官网显示阿斯利康奥拉帕利片新适应症上市申请拟纳入优先审评,单药用于治疗携带BRCA1/2突变(胚系和/或体细胞系)且在既往新型激素药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌成人患者。FDA批准的首个口服多腺苷二磷酸核糖聚合酶(PARP)抑制剂,通过抑制PARP酶活性和防止PARP与DNA解离,协同DNA损伤修复功能缺陷,杀死肿瘤细胞。最早于201
奥拉帕利新适应症上市申请拟纳入优先审评,治疗前列腺癌
1月21日,CDE官网显示阿斯利康奥拉帕利片新适应症上市申请拟纳入优先审评,单药用于治疗携带BRCA1/2突变(胚系和/或体细胞系)且在既往新型激素药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌成人患者。奥拉帕利是FDA批准的首个口服多腺苷二磷酸核糖聚合酶(PARP)抑制剂,通过抑制PARP酶活性和防止PARP与DNA解离,协同DN
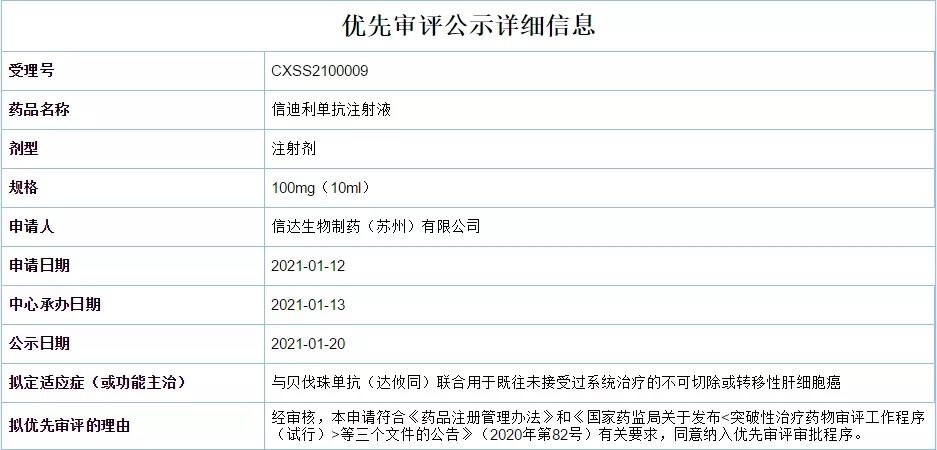
信达生物信迪利单抗+贝伐珠单抗一线治疗肝细胞癌上市申请拟纳入优先审评
近日,CDE官网显示,信达生物信迪利单抗联合贝伐珠单抗(达攸同)一线治疗肝细胞癌适应症上市申请拟纳入优先审评。2020年11月,信达生物公布了信迪利单抗联合贝伐珠单抗一线治疗肝癌临床研究(ORIENT-32)结果,与索拉菲尼组相比,信迪利单抗联合贝伐珠单抗组死亡风险下降43.1%,疾病进展风险下降43.5%。信迪利单抗联合贝伐珠单抗组
康宁杰瑞KN035(恩沃利单抗注射液)获国家药监局纳入优先审评!
首个申请的适应症为:既往标准治疗失败的微卫星不稳定(MSI-H)晚期结直肠癌、胃癌/错配修复功能缺陷(dMMR)。
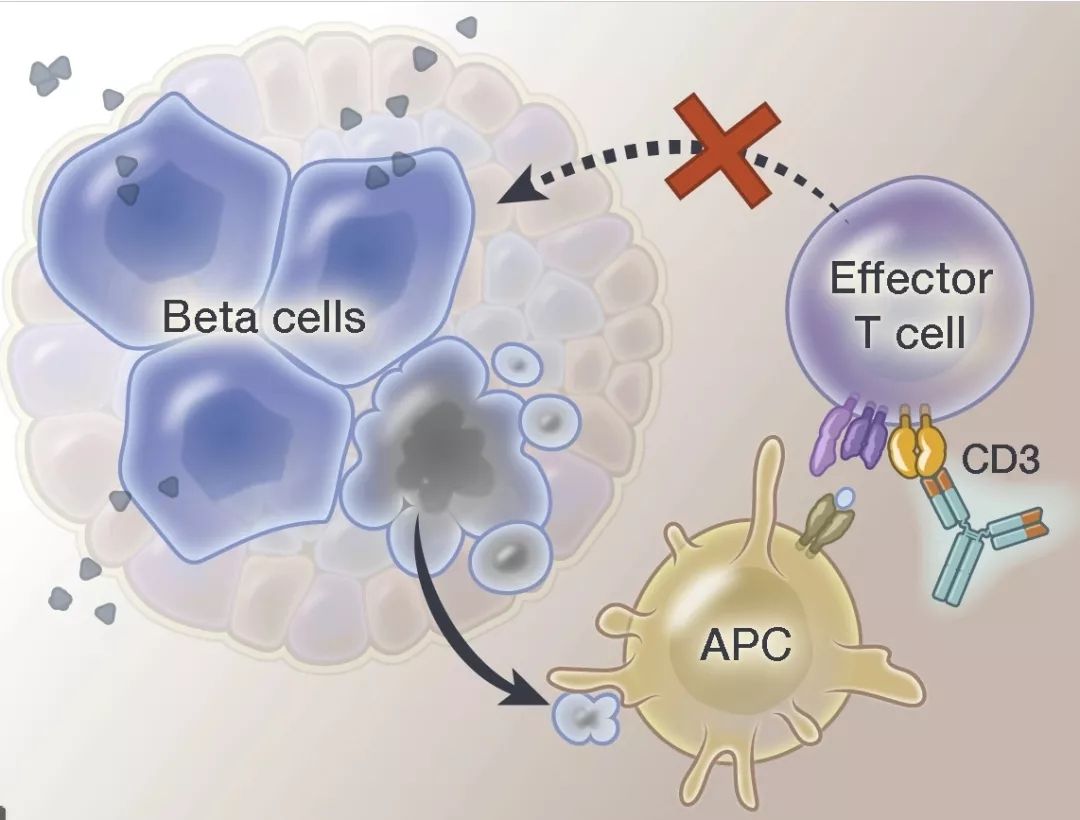
突破性疗法teplizumab获FDA优先审评资格
1月4日,Provention Bio公司宣布已向FDA递交CD3单克隆抗体teplizumab的生物制品许可申请(BLA),用于延迟或预防高危患者的临床1型糖尿病(T1D)。FDA已授予teplizumab上市申请优先审评资格,PDUFA预定审批期限为2021年7月2日。被授予优先审评的药物意味着其在治疗、诊断或预防严重疾病安全性或有效性方面与
海正药业海泽麦布片被纳入优先审评程序
2020年12月21日,根据国家药品审评中心(CDE)官网信息显示,海正药业的化学1类新药海泽麦布片(10mg)已 被正式纳入优先审评品种名单。该药品于12月11日被CDE纳入拟优先审评品种公示名单。2019年1月9日,CDE受理了公司递交的海泽麦布片(10mg、20mg)的药品注册申请;2019年3月20日,海泽麦布片(
CDE发布药品审评中心补充资料工作程序试行通告
今日,CDE官网发布《药品审评中心补充资料工作程序(试行)》的通告(2020年第42号)。为配合《药品注册管理办法》的贯彻实施,进一步规范药品注册审评补充资料管理工作,结合药品审评以流程为导向的科学管理体系的研究成果和审评工作实际,药审中心研究制定了《药品审评中心补充资料工作程序(试行)》。本程序自2020年12月1日起施行,本工作程序中附件《药
恒瑞医药卡瑞利珠单抗又一上市申请拟纳入优先审评
恒瑞医药发布公告称,其子公司苏州盛迪亚生物医药有限公司的注射用卡瑞利珠单抗申报生产,拟联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗,该药品注册申请已获国家药监局受理,并纳入拟优先审评审批程序。药品名称:注射用卡瑞利珠单抗剂型:注射剂规格:200mg/瓶注册分类:治疗用生物制品1类申报阶段:生产申请人:苏州盛迪亚生物医药有限公司拟优先