CDD:抑制USP28通过抑制范可尼贫血通路来克服鳞状肿瘤的顺铂耐药
来源:本站原创 2021-10-26 12:16
鳞状细胞癌(SCC)通常具有异常高的突变负担。因此,他们迅速对以铂为基础的化疗产生耐药性,总体生存受到限制。
鳞状细胞癌(SCC)通常具有异常高的突变负担。因此,他们迅速对以铂为基础的化疗产生耐药性,总体生存受到限制。因此,迫切需要新的治疗策略。SCC表达ΔNp63,调节癌症细胞中的范可尼贫血(FA) dna损伤反应,从而促进化疗耐药。在这里,作者报道了去泛素化酶USP28被招募到顺铂处理细胞的DNA损伤位点。ATR使USP28磷酸化并增加其酶活性。
这一磷酸化事件需要通过稳定ΔNp63来积极调节SCC中的DNA损伤修复。在铂基化疗期间,特定抑制剂对USP28的敲除或抑制削弱了SCC应对DNA损伤的能力。因此,该研究提出了一个新的机制,通过ΔNp63表达的SCC可以靶向克服化疗耐药。在鳞状癌患者中,有限的治疗选择和低的化疗反应率特别常见。SCC特异性转录因子ΔNp63增强Fanconi贫血基因的表达,从而促进重组DNA修复和顺铂耐药。靶向SCC中的USP28-ΔNp63轴可以减弱这种DNA损伤反应途径,从而使SCC细胞对顺铂治疗敏感。
图片来源:https://doi.org/10.1038/s41418-021-00875-z
鳞状肿瘤发生于多种组织,是最高度突变的癌症实体之一。目前的治疗选择是诱导DNA损伤的化疗或个性化的方法,如受体酪氨酸激酶(RTK)和免疫检查点抑制剂。虽然肿瘤最初有反应,但它们经常产生耐药性。防止癌细胞逃避治疗的一种可能的策略是靶向参与维持鳞状细胞癌身份或生存的蛋白质。其中一个将SCC与其他肿瘤实体区分开来的因子是ΔNp63,它是一种原致癌转录因子,是TP53超家族的成员,是SCC形成的主要调控因子。
鳞状细胞癌依赖ΔNp63维持基底上皮细胞的特性。在自体鳞状细胞癌模型中,ΔNp63的急性缺失导致肿瘤快速消退。这部分是通过直接干扰tap73依赖的凋亡来介导的,这可以通过促进凋亡基因PUMA和NOXA的表达增强来证实。此外,ΔNp63有助于SCC对铂基化疗的耐药,因为它能够调节dna损伤反应(DDR)基因的表达。具体来说,编码范可尼贫血通路蛋白的基因直接受到ΔNp63的调控。ΔNp63与该途径的几个基因的启动子结合,并在治疗期间驱动它们的表达。
SCC的一个弱点是它对去泛素化酶(DUB)
USP28的依赖。USP28稳定ΔNp63蛋白,是SCC肿瘤维持所必需的。一致地,第一代小分子抑制剂USP28 (AZ1)在小鼠同种基因移植模型中抑制肿瘤生长。通过它的几个底物,USP28参与染色质稳定性,分离和DNA损伤信号,但它是否在DNA损伤的反应中有作用尚不清楚。在这里,作者报道了USP28通过ΔNp63在顺铂化疗期间维持SCC的基因组完整性,并且靶向USP28可使ΔNp63阳性SCC对化疗敏感。
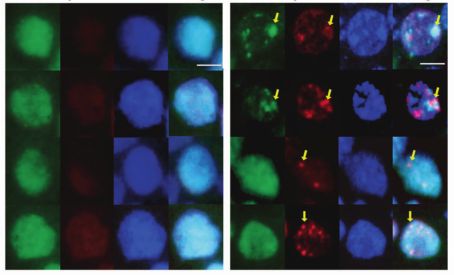
顺铂作用下USP28的磷酸化是修复鳞癌DNA损伤所必需的。
图片来源:https://doi.org/10.1038/s41418-021-00875-z
在这项研究中,作者发现USP28被招募到顺铂诱导的DNA损伤位点,导致与ATR的相互作用和USP28的磷酸化。USP28随后的磷酸化导致USP28酶活性的增加和USP28底物的稳定,如MYC和ΔNp63。ATR的抑制导致USP28的降解,因为dub的蛋白质稳定性与它们的活性有关。在SCC中,ΔNp63是通过控制DNA修复基因的表达来调控化疗抗性的重要因子。
USP28的敲除或药理学抑制均降低ΔNp63蛋白水平及其下游靶点,包括DNA修复蛋白FANCD2、FANCI或RAD51C。因此,在表达SCC的ΔNp63中,USP28的抑制与顺铂协同作用,导致DNA损伤增强,并以剂量依赖的方式降低了SCC的总生存率。值得注意的是,抑制USP28在人腺癌细胞系和不表达ΔNp63的SCC细胞系SiHa,导致ɣ-H2AX的降低,与顺铂联合治疗没有添加或协同作用。在其他肿瘤实体中也有类似的观察结果,其中USP28的缺失导致了治疗耐药性。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。




