基因编辑同种异体CD19 CAR-T细胞疗法!美国FDA授予CTX110再生医学先进疗法(RMAT)资格!
来源:本站原创 2021-11-24 03:50
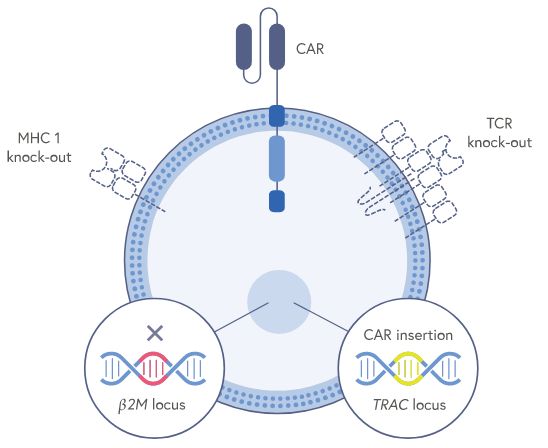
CTX110由CRISPR Therapeutics开发,是一种来源于健康供体的基因编辑同种异体CD19 CAR-T细胞疗法。
CTX110(图片来源:crisprtx.com)
2021年11月24日讯 /生物谷BIOON/ --基因编辑龙头公司CRISPR Therapeutics近日宣布,美国食品和药物管理局(FDA)已授予CTX110再生医学先进疗法(RMAT)资格:这是一款由该公司全资拥有的基因编辑同种异体CAR-T细胞疗法,用于治疗复发或难治性CD19+B细胞恶性肿瘤。CRISPR Therapeutics利用CRISPR/Cas9基因编辑技术,对来源于健康供体的T细胞进行3次基因编辑,允许其CAR-T细胞“通用(off-the-shelf)”。
再生医学先进疗法(RMAT)是2016年12月美国修改“21世纪治愈法案(21st Century Cures Act)”的再生医疗条款时,为了加速创新再生疗法的开发和审批而制定的一种Fast track(快速通道)制度。RMAT可以是细胞疗法、治疗性组织工程产品、人类细胞及组织制品,或是其他包含了再生医学技术制品的联合疗法。
在研药物要获得RMAT资格认定,必须要有初步的临床研究数据证明药物在治疗、延缓、逆转或治愈严重或危及生命的疾病或是在未满足医疗需求方具有积极的结果。RMAT资格认定包括了快速通道资格(FTD)和突破性药物资格(BTD)的全部优惠政策,包括与FDA进行早期互动、优先审查、加速审批的可能性。
CRISPR Therapeutics首席执行官Samarth Kulkarni博士表示:“这项RMAT资格认定,基于我们迄今为止提供的令人鼓舞的临床数据,这是一个重要的里程碑,表明FDA认可了CTX110在血液系统恶性肿瘤治疗中的变革性潜力。我们期待着与FDA密切合作,继续努力将这一重要的新治疗方式带给患者。”
自体CAR-T与同种异体CAR-T(图片来源:crisprtx.com,点击图片查看大图)
CTX110是一种来源于健康供体的基因编辑同种异体CAR-T细胞疗法,靶向CD19,这是目前CAR-T开发的热门靶点。CD19是簇分化抗原的一种,是B细胞增殖、分化、活化及抗体产生有关的重要膜抗原。
目前,一项单臂、多中心、开放标签1期临床试验CARBON,正在评估几种剂量水平的CTX110治疗复发或难治性B细胞恶性肿瘤的安全性和有效性。该试验入组的是先前接受过至少2线治疗的复发或难治性B细胞CD19+恶性肿瘤成人患者。
今年10月公布的数据显示:意向性治疗(ITT)人群中,在剂量水平2(DL2:100x10E6)和更高水平的单剂量CTX110治疗下,大B细胞淋巴瘤(LBCL)患者中的总缓解率(ORR)达到了58%,完全缓解率(CR)达到了38%。此外,LBCL患者中缓解持久,6个月CR率为21%,最长的缓解在首次输注后18个月仍然维持。
该试验中,CTX110的缓解率和持久性,与ITT基础上批准的自体CD19 CAR-T疗法相似。CTX110具有积极的差异化安全特征,无3级或更高级别的细胞因子释放综合征(CRS),具有低的感染率及免疫效应细胞相关神经毒性综合征(ICANS)发生率。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->




