Cancer Cell:给CAR-T细胞装上一个安全开关,可微调它们的活性
来源:本站原创 2020-02-01 16:27
2020年2月1日讯/生物谷BIOON/---在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员报道了关于共刺激分子调控的新发现。这些发现有可能允许人们对激活杀死癌症的免疫细胞---经过基因改造后表达嵌合抗原受体(CAR)的T细胞(CAR-T)---进行微调,从而提高它们杀死肿瘤的能力,或者在严重副作用的情形下降低它们的活性。相关研究结果于2020
2020年2月1日讯/生物谷BIOON/---在一项新的研究中,来自美国北卡罗来纳大学教堂山分校的研究人员报道了关于共刺激分子调控的新发现。这些发现有可能允许人们对杀死癌症的免疫细胞---经过基因改造后表达嵌合抗原受体(CAR)的T细胞(CAR-T)---进行微调,从而提高它们杀死肿瘤的能力,或者在严重副作用的情形下降低它们的活性。相关研究结果于2020年1月30日在线发表在Cancer Cell期刊上,论文标题为“THEMIS-SHP1 Recruitment by 4-1BB Tunes LCK-Mediated Priming of Chimeric Antigen Receptor-Redirected T Cells”。论文通讯作者为北卡罗来纳大学教堂山分校莱恩伯格综合癌症中心的Gianpietro Dotti博士。
论文共同第一作者、北卡罗来纳大学教堂山分校莱恩伯格综合癌症中心博士后研究员Peishun Shou博士说,“在免疫学中,这总是与平衡有关;你不能有太多的T细胞活化,也不能有过低的T细胞活化。我们想要将T细胞活化和肿瘤杀死保持在适当或可持续的水平。”
细胞免疫疗法
CAR-T细胞免疫疗法涉及从患者体内提取T细胞,在实验室中对它们进行基因改造,使得它们可以寻找表面上呈现特定分子靶标的肿瘤细胞,随后将它们重新灌注回相同患者体内来抵抗癌症。通过临床免疫疗法计划,这些研究人员已设计了针对霍奇金淋巴瘤、非霍奇金淋巴瘤、多发性骨髓瘤、成神经细胞瘤和白血病的新型实验性CAR-T细胞免疫疗法,这些疗法正在临床试验中开展研究。
Dotti说,“我们正在开展针对液体瘤和实体瘤的CAR-T细胞临床研究。在这些研究中,我们正在测试我们所谓的‘新一代’CAR-T细胞,以期进一步提高这种技术的治疗指数(therapeutic index)。这项新的研究强调了当转化科学和基础科学结合在一起时,我们如何有望改进治疗策略。”
CAR-T细胞免疫疗法研究结果
在这项新的研究中,这些研究人员揭示了对实验性CAR-T细胞进行基因改造的新策略,以增加经过基因修饰的T细胞的活性来更加有效地杀死肿瘤细胞,或者在这类疗法触发严重副作用的情形下降低这些T细胞的活性。
他们开发出对两种不同类型的经过基因修饰的T细胞进行改进的策略。这两种类型的CAR-T细胞可通过激活它们的信号来加以区分。首先,它们具有识别肿瘤上特定标志物的受体---第一个信号。它们还需要第二个信号来协助完全激活它们并增加它们的反应。这两种不同类型的T细胞需要不同的“第二信号”来激活它们。
一种类型的CAR-T细胞由CD28蛋白共同刺激,另一种类型的CAR-T细胞由4-1BB刺激。 这些研究人员希望找到一种调节这些蛋白的方法,以“微调”这些细胞的抗疾病反应,这是因为这两种类型的CAR-T细胞在体内通常持续存在多长时间来抵抗癌症、它们如何快速地作出反应以及这种反应的强度上存在差异。
Shou说,“T细胞必须受到激活才能杀死肿瘤细胞。如果它们受到更好的激活,那么它们就会释放更多的细胞因子……这些T细胞可以更好地靶向肿瘤并杀死它。在某些情况下,我们想要让T细胞变得强大和更活跃,并且根据肿瘤类型,我们可能想要调低T细胞活化以帮助这些T细胞存活和增殖。”
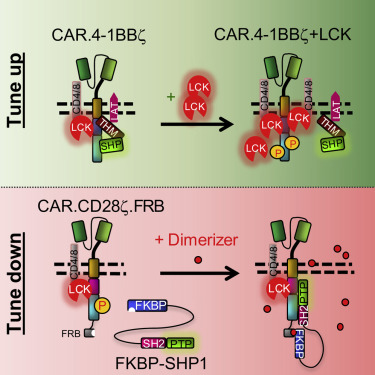
对于由4-1BB共同刺激的CAR-T细胞,这些研究人员发现他们可以增加LCK分子的表达,从而增加这些细胞的活性。
Shou说,“我们发现LCK分子可以与CAR结合,从而增强CAR-T细胞的活化和信号转导,因此将有助于CAR-T细胞实现更好的肿瘤杀伤作用。”
CAR-T细胞安全开关功能
这些研究人员还报道了一种新的“安全开关”机制以降低由CD28共同刺激的CAR-T细胞的活性。如果患者在实验性CAR-T细胞免疫疗法中经历严重的副作用,那么医生就可能使用这种安全开关。
他们发现他们可以使用一种称为SHP1的分子来降低T细胞活性。当他们添加某种药物时,SHP1会与CAR结合,从而降低CAR-T细胞的活性。
Shou说,“在这种药物的存在下,我们可以调低CAR-T细胞的活化。这种安全开关的优势在于它不会杀死CAR-T细胞;只是暂时下调它们的活性。”
这些研究人员想要利用这些发现进行调查,以改善针对白血病等血液癌症的CAR-T细胞免疫疗法,并潜在地改善针对实体瘤的实验性治疗。
Shou说,“CAR-T细胞免疫疗法领域的科学家们如今希望解决实体瘤问题。实体瘤具有免疫抑制性微环境,因此需要更强的CAR-T细胞活化。”(生物谷 Bioon.com)
参考资料:
1.Chuang Sun et al. THEMIS-SHP1 Recruitment by 4-1BB Tunes LCK-Mediated Priming of Chimeric Antigen Receptor-Redirected T Cells. Cancer Cell, 2020, doi:10.1016/j.ccell.2019.12.014.
2.UNC Lineberger discovery would allow researchers to fine-tune activity of cancer-hunting immune cells
https://unclineberger.org/news/car-t-immunotherapy-study-improving-cancer-killing-immune-cells/

图片来自Cancer Cell, 2020, doi:10.1016/j.ccell.2019.12.014。
论文共同第一作者、北卡罗来纳大学教堂山分校莱恩伯格综合癌症中心博士后研究员Peishun Shou博士说,“在免疫学中,这总是与平衡有关;你不能有太多的T细胞活化,也不能有过低的T细胞活化。我们想要将T细胞活化和肿瘤杀死保持在适当或可持续的水平。”
细胞免疫疗法
CAR-T细胞免疫疗法涉及从患者体内提取T细胞,在实验室中对它们进行基因改造,使得它们可以寻找表面上呈现特定分子靶标的肿瘤细胞,随后将它们重新灌注回相同患者体内来抵抗癌症。通过临床免疫疗法计划,这些研究人员已设计了针对霍奇金淋巴瘤、非霍奇金淋巴瘤、多发性骨髓瘤、成神经细胞瘤和白血病的新型实验性CAR-T细胞免疫疗法,这些疗法正在临床试验中开展研究。
Dotti说,“我们正在开展针对液体瘤和实体瘤的CAR-T细胞临床研究。在这些研究中,我们正在测试我们所谓的‘新一代’CAR-T细胞,以期进一步提高这种技术的治疗指数(therapeutic index)。这项新的研究强调了当转化科学和基础科学结合在一起时,我们如何有望改进治疗策略。”
CAR-T细胞免疫疗法研究结果
在这项新的研究中,这些研究人员揭示了对实验性CAR-T细胞进行基因改造的新策略,以增加经过基因修饰的T细胞的活性来更加有效地杀死肿瘤细胞,或者在这类疗法触发严重副作用的情形下降低这些T细胞的活性。
他们开发出对两种不同类型的经过基因修饰的T细胞进行改进的策略。这两种类型的CAR-T细胞可通过激活它们的信号来加以区分。首先,它们具有识别肿瘤上特定标志物的受体---第一个信号。它们还需要第二个信号来协助完全激活它们并增加它们的反应。这两种不同类型的T细胞需要不同的“第二信号”来激活它们。
一种类型的CAR-T细胞由CD28蛋白共同刺激,另一种类型的CAR-T细胞由4-1BB刺激。 这些研究人员希望找到一种调节这些蛋白的方法,以“微调”这些细胞的抗疾病反应,这是因为这两种类型的CAR-T细胞在体内通常持续存在多长时间来抵抗癌症、它们如何快速地作出反应以及这种反应的强度上存在差异。
Shou说,“T细胞必须受到激活才能杀死肿瘤细胞。如果它们受到更好的激活,那么它们就会释放更多的细胞因子……这些T细胞可以更好地靶向肿瘤并杀死它。在某些情况下,我们想要让T细胞变得强大和更活跃,并且根据肿瘤类型,我们可能想要调低T细胞活化以帮助这些T细胞存活和增殖。”
对于由4-1BB共同刺激的CAR-T细胞,这些研究人员发现他们可以增加LCK分子的表达,从而增加这些细胞的活性。
Shou说,“我们发现LCK分子可以与CAR结合,从而增强CAR-T细胞的活化和信号转导,因此将有助于CAR-T细胞实现更好的肿瘤杀伤作用。”
CAR-T细胞安全开关功能
这些研究人员还报道了一种新的“安全开关”机制以降低由CD28共同刺激的CAR-T细胞的活性。如果患者在实验性CAR-T细胞免疫疗法中经历严重的副作用,那么医生就可能使用这种安全开关。
他们发现他们可以使用一种称为SHP1的分子来降低T细胞活性。当他们添加某种药物时,SHP1会与CAR结合,从而降低CAR-T细胞的活性。
Shou说,“在这种药物的存在下,我们可以调低CAR-T细胞的活化。这种安全开关的优势在于它不会杀死CAR-T细胞;只是暂时下调它们的活性。”
这些研究人员想要利用这些发现进行调查,以改善针对白血病等血液癌症的CAR-T细胞免疫疗法,并潜在地改善针对实体瘤的实验性治疗。
Shou说,“CAR-T细胞免疫疗法领域的科学家们如今希望解决实体瘤问题。实体瘤具有免疫抑制性微环境,因此需要更强的CAR-T细胞活化。”(生物谷 Bioon.com)
参考资料:
1.Chuang Sun et al. THEMIS-SHP1 Recruitment by 4-1BB Tunes LCK-Mediated Priming of Chimeric Antigen Receptor-Redirected T Cells. Cancer Cell, 2020, doi:10.1016/j.ccell.2019.12.014.
2.UNC Lineberger discovery would allow researchers to fine-tune activity of cancer-hunting immune cells
https://unclineberger.org/news/car-t-immunotherapy-study-improving-cancer-killing-immune-cells/
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


