STING激动剂获批临床
来源:医药魔方 2021-04-19 12:14
成都先导发布公告,该公司创新药注射用HG381的临床试验申请已获得国家药监局默认许可,拟开展治疗晚期实体瘤临床研究。该产品是首个在中国获批开展临床试验的针对STING靶点的非核苷酸类激动剂。也是成都先导第3个获得临床试验许可的新药项目。另两个项目分别为HG030片(ROS1/NTRK双靶点抑制剂)、HG146(HDAC I/IIb亚型
成都先导发布公告,该公司创新药注射用HG381的临床试验申请已获得国家药监局默认许可,拟开展治疗晚期实体瘤临床研究。该产品是首个在中国获批开展临床试验的针对STING靶点的非核苷酸类激动剂。也是成都先导第3个获得临床试验许可的新药项目。另两个项目分别为HG030片(ROS1/NTRK双靶点抑制剂)、HG146(HDAC I/IIb亚型选择性抑制剂)。
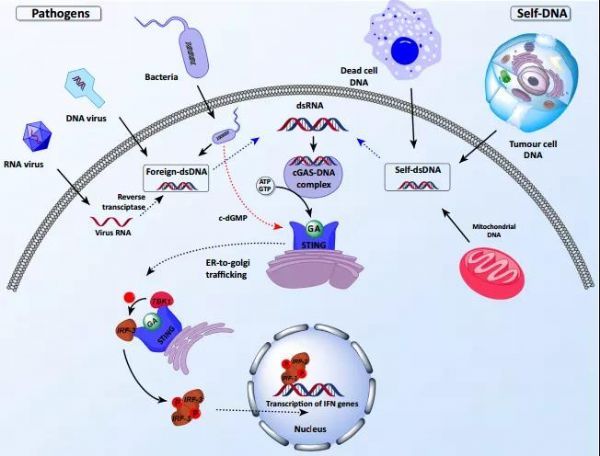
人体的固有免疫系统通过模式识别受体(PRR)识别病原微生物体中的分子,并触发免疫激活反应。干扰素基因刺激因子(STING)通路在病原体识别过程中发挥关键作用。STING能够识别细胞质中异常DNA或环状二核苷酸(CDN),从而激发众多宿主防御基因(包括I型干扰素(IFN)和促炎性细胞因子)的转录,产生免疫应答。除了对病原体的先天免疫之外,死亡细胞或肿瘤细胞释放的DNA也会触发STING激活。
HG381是成都先导基于DNA编码化合物库技术及小分子新药研发平台自主研发的新分子实体。前期的临床前药效试验表明HG381在结肠癌、肝癌、乳腺癌、肺癌等多个小鼠肿瘤模型中都表现出显着疗效,而且能够诱导机体产生肿瘤免疫记忆,抑制肿瘤再生。在临床前药物安全性评价实验中,HG381展现良好的安全窗。同时,HG381有着作为单药或者与免疫检查点抑制剂联用进行临床应用的前景。
目前国际上有数个基于该机制的创新药品种处于早期临床试验阶段。2015年3月,诺华和Aduro就临床前项目ADU-S100签订合作,合同总额高达7.5亿美元。2017年,BMS与IFM公司针对STING激动剂达成了一项总金额达23亿美元的交易。
诺华的从Aduro获得的ADU-S100和默沙东的MK-1454都是小分子环二核苷酸(cGAMP)天然配体衍生物,这类药物由于稳定性较差,只能通过瘤内注射给药,给药物的开发和临床应用带来一定的困难。于是GSK等公司开始开发第二代、非环二核苷酸类小分子STING激动剂,全球现有包括GSK、Taketa、Silicon Therapeutics等3家公司开发的非环二核苷酸类小分子STING激动剂进入早期临床研究阶段。成都先导的HG381也属于二代、非环二核苷酸类小分子STING激动剂。
国内企业中,嘉和生物开发的STING激动剂IMSA101已在国外开展I期临床。阿诺医药(AN3005)、海和药物(SOMCL-18-202)、迪诺医药(DN015089)同靶点药物均处于临床前开发阶段。(生物谷Bioon.com)
小编推荐会议 2021 RWE真实世界研究峰会(第五届)
http://meeting.bioon.com/RWE
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。