多篇重磅级文章解读科学家们在HIV研究领域取得的新进展!
来源:生物谷原创 2024-08-30 12:45
实验性单次注射疗法展现惊人潜力,能够在长达30周内显著压制非人灵长类动物体内的SHIV水平、实验性药物BLZ945有望根除隐藏大脑中的HIV
本文中,小编整理了近期科学家们发表的多篇重磅级研究成果,共同解读他们在HIV研究领域取得的新进展,分享给大家!
【1】Science:实验性单次注射疗法展现惊人潜力,能够在长达30周内显著压制非人灵长类动物体内的SHIV水平
doi:10.1126/science.adn5866
近日,一篇发表在国际杂志Science上题为“Engineered deletions of HIV replicate conditionally to reduce disease in nonhuman primates”的研究报告中,来自俄勒冈健康等机构的科学家们在HIV研究领域取得了突破性的成果,他们发现一种实验性的单一注射能够在长达30周的时间内显著抑制非人灵长类动物体内的猿猴/人类免疫缺陷病毒(SHIV)水平。
SHIV是一种混合了猿猴免疫缺陷病毒(SIV)与人类免疫缺陷病毒(HIV-1)基因片段的病毒,常用于研究HIV的不同基因功能以及病毒与宿主的互动。本研究的发现意味着实验室合成的注射剂或能成为一种更简便、持久的替代方案(当前HIV感染者的标准治疗需要严格的用药依从性)。研究人员发现,治疗性干扰颗粒(TIPs)能够将非人灵长类动物体内的SHIV水平降低至少1000倍,在六只接受治疗的动物中,有五只的病毒水平显著下降。在一只接受治疗的动物中,SHIV含量降低至检测不到的水平。TIPs是由实验室设计的非致病性HIV病毒片段,其快速繁殖,与HIV竞争资源,旨在抑制感染者体内的病毒活性。
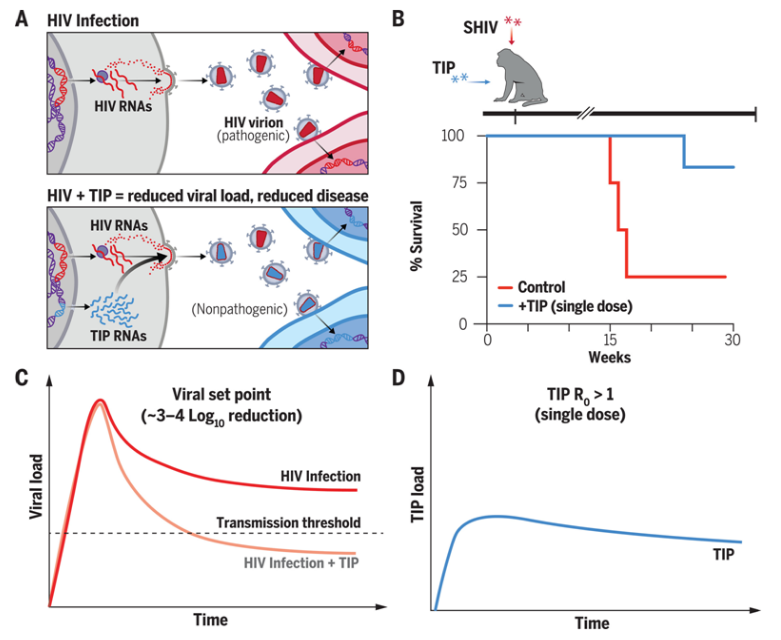
单剂量HIV治疗:TIP通过有条件复制减少非人类灵长类动物的疾病
图片来源:Science, 2024, doi:10.1126/science.adn5866
研究者Leor Weinberger博士在2000年代初期首次通过计算模型提出了TIP的概念,并在后续的实验室研究和小鼠实验中验证了这一理论。共同作者、俄勒冈健康与科学大学的Nancy Haigwood博士表示:“我们看到的疾病进程改变是前所未有的。如果TIP能在人类HIV感染中产生与我们在非人灵长类动物研究中观察到的相同效果,那么这将开启一条新的治疗途径,可能使人们无需终身服药。这是令人振奋的。”
【2】Brain:实验性药物BLZ945有望根除隐藏大脑中的HIV
doi:10.1093/brain/awae153
猿猴免疫缺陷病毒(SIV)与人类免疫缺陷病毒(HIV)亲缘关系密切。它是一种逆转录病毒,可导致至少45种非洲非人类灵长类动物持续感染。近日,一篇发表在国际杂志Brain上题为“CSF1R inhibition depletes brain macrophages and reduces brain virus burden in SIV-infected macaques”的研究报告中,来自杜兰大学等机构的研究人员通过研究首次发现一种最初为治疗癌症而开发的实验性药物可能有助于清除大脑中受感染细胞中的HIV。他们指出这种药物通过靶向清除某些携带SIV的免疫细胞,显著降低了非人灵长类动物大脑中SIV的水平。鉴于HIV病毒库中,HIV躲避了其他有效的治疗方法,这一发现标志着人类朝着从难以触及的HIV病毒库中消灭这种病毒迈出了重要一步。
研究者Woong-Ki Kim 博士表示,这项研究是解决HIV引起的脑部相关问题的重要一步,即使人们服用了有效的抗HIV药物,这些问题仍然会对他们造成影响。通过特异性地靶向大脑中受感染的细胞,我们或许能够清除这些隐藏区域中的HIV,而这一直是HIV治疗中的一大难题。
抗逆转录病毒药物(ART)是成功治疗HIV感染的重要组成部分,它可以将血液中的HIV维持在检测不到的水平,并将艾滋病从一种绝症转变为一种可以控制的疾病。然而,ART并不能完全根除HIV,患者需要终生治疗。这种病毒仍然存在于大脑、肝脏和淋巴结的“HIV病毒库”中,在那里,ART无法将它清除。
【3】Gene Ther:突破性研究发现HIV样病毒颗粒或终结HIV感染者终身服药时代
doi:10.1038/s41434-024-00467-9
近日,一篇发表在国际杂志Gene Therapy上题为“Suppression of viral rebound by a Rev-dependent lentiviral particle in SIV-infected rhesus macaques”的研究报告中,来自乔治-梅森大学传染病研究中心等机构的研究人员开展了一项突破性的概念验证研究,发现了一种类似艾滋病病毒(HIV)的病毒颗粒,可能让患者不再需要终身服药。几十年来,科学家们在治疗HIV(即人类免疫缺陷病毒)方面取得了显著进展,但由于这种病毒难以根除,HIV感染者仍然需要终生服用抗逆转录病毒药物(ART)。在这项新的研究中,通讯作者、乔治-梅森大学系统生物学学院教授Yuntao Wu及其团队开发了一种特殊的HIV样病毒颗粒——HIV Rev依赖性慢病毒载体,它利用HIV蛋白Rev作为触发器,选择性地靶向和激活HIV感染细胞中的治疗基因。

突破性研究发现HIV样病毒颗粒或终结HIV感染者终身服药时代
图片来源:Gene Therapy, 2024, doi:10.1038/s41434-024-00467-9
研究团队自2002年起就开始研发HIV Rev依赖性载体技术。Wu指出,由于HIV病毒库(即携带病毒的受感染免疫细胞)的存在,患者需要终生服药。当前的ART药物虽然能有效阻止病毒复制,但无法清除HIV病毒库。目前,正在探索通过“激活并杀死”(shock and kill)或“阻断并锁定”(block and lock)的策略来消除或抑制HIV病毒库。
Wu表示,他们团队开发的HIV Rev依赖性慢病毒载体技术采用了另一种方法,即利用HIV Rev蛋白选择性地靶向HIV病毒库来杀灭或灭活HIV。“我们的方法不仅能够减少HIV病毒库,还显示出增强免疫系统产生抗病毒中和抗体的能力。”Wu解释道,“这就好比将敌人转化为盟友。”
【4】Cell:新研究发现一种实验性HIV疫苗可在人体中诱导广泛中和抗HIV抗体产生
doi:10.1016/j.cell.2024.04.033
近日,一篇发表在国际杂志Cell上题为“Vaccine induction of heterologous HIV-1-neutralizing antibody B cell lineages in humans”的研究报告中,来自杜克大学等机构的科学家们通过研究开发出了一种新型HIV候选疫苗,在2019年的小规模临床试验中,成功激发了参与者体内产生广泛的中和抗体,对抗HIV病毒。这一成就不仅证实了疫苗能够激发抗体以对抗多种HIV毒株,而且还能在数周内启动这一种重要的免疫反应。
这种候选疫苗靶向HIV-1外包膜上一个叫做近膜端外部区(membrane proximal external region, MPER)的区域,这一区域即使在病毒变异中依旧稳定,为攻克HIV提供了稳定靶点。此区域的抗体能够拦截多种HIV流行株,展现出广泛防护潜力。研究者Barton F. Haynes博士表示,这项研究向前迈出了一大步,因为它证明了通过免疫系统产生对抗最棘手HIV株抗体的可能性。接下来,我们将致力于增强针对HIV其他位点的抗体,封堵住病毒逃逸路径。虽目前还未全胜,但方向已清晰。”
研究人员分析了Haynes和S. Munir Alam 博士在杜克大学人类疫苗研究所研发的候选疫苗的1期临床试验数据。20名健康、HIV阴性的人参加了这项临床试验。在计划的四次实验性疫苗接种中,15 人接种了两次,5 人接种了三次。
【5】Nat Microbiol:揭秘HIV难杀之谜!独特的RNA修饰结构让病毒遁形于免疫追击
doi:10.1038/s41564-024-01638-5
近日,一篇发表在国际杂志Nature Microbiology上题为“Single-molecule epitranscriptomic analysis of full-length HIV-1 RNAs reveals functional roles of site-specific m6As”的研究报告中,来自俄亥俄州立大学等机构的科学家们通过研究发现,人类免疫缺陷病毒1型(HIV-1)RNA基因组中一种争议颇多的化学修饰可能在感染宿主细胞后病毒的生存与繁殖中扮演着关键角色。
HIV-1 RNA的改变是一种对RNA腺苷组成部分m6A的微小化学修饰,其是所有生命形式中最常见的RNA编辑过程,主要涉及改变基因表达和蛋白质产生,这种功能性效应通常会代表细胞解决策略,但在某些情况下却会引起疾病。通过创新技术深入探索HIV-1 RNA的全长构造,研究者发现,m6A修饰几乎仅发生在HIV-1 RNA基因组的三个特定位点上(在潜在的242个位点中),且这三个特定的m6A修饰对病毒复制不可或缺,暗示了这种冗余性可能是病毒自身演化出的策略。
揭示特殊的RNA化学修饰让HIV-1获益的分子机制
图片来源:Nature Microbiology (2024). DOI:10.1038/s41564-024-01638-5
Sanggu Kim博士指出:“这些特定位置对病毒蛋白的生成和病毒基因组RNA的复制都至关重要。有趣的是,HIV何以维持多个m6A修饰?我们的研究揭示,m6A之所以关键,在于HIV利用这些修饰的冗余性作为保障,即使个别m6A丢失,病毒依然能够生存,但若全部缺失,则会严重影响病毒功能。”
【6】J Control Release:HIV疗法新突破!一种可植入设备或能比口服药物更加有效地运输HIV抗病毒药物!
doi:10.1016/j.jconrel.2023.12.031
治疗不依从性(treatment nonadherence),作为影响HIV感染者(PLWH,people living with HIV)健康状况的关键因素,构成了一个亟待解决的现实挑战。这些个体在与病毒共存的漫长旅程中,必须严格遵循终身抗逆转录病毒治疗(ART)方案,以确保病毒载量持续处于抑制状态。然而,一旦出现治疗不依从现象,即患者未能按照医嘱规律用药,不仅可能导致抗病毒药物效力减弱、病毒耐药性的快速滋生,还会触发一系列严重的后果:病毒传播风险加剧、艾滋病(AIDS)病程加速进展,以及随之而来的患者发病率与死亡率的攀升。
近日,一篇发表在国际杂志Journal of Controlled Release上题为“Antiviral potency of long-acting islatravir subdermal implant in SHIV-infected macaques”的研究报告中,来自休斯敦卫理公会研究所等机构的科学家们通过研究发现,一种纳米流体可植入物或能运输HIV药物,其要比其它形式的口服或HIV药物更加有效。相关研究结果有望帮助开发出长效、可重复使用的可植入物,从而将HIV抗病毒药物依斯拉韦运输到HIV感染者体内。
目前,依斯拉韦是一种试验性的药物,患者每天或每周联合用药一次,这项研究中,研究人员重点关注了在低剂量连续皮下给药时药物的疗效、潜力和耐受性。研究者Grattoni说道,持续皮下洗脱依斯拉韦的效力要比药物卡博特韦(cabotegravir)的效力高5倍,而卡博特韦是一种用于预防和治疗HIV感染的肌肉内可注射的抗病毒药物。
【7】Nature:揭示HIV进入细胞核并引发感染机制
doi:10.1038/s41586-023-06969-7
近日,一篇发表在国际杂志Nature上题为“The HIV capsid mimics karyopherin engagement of FG-nucleoporins”的研究报告中,来自澳大利亚新南威尔士大学等机构的科学家们通过研究发现了人类免疫缺陷病毒(HIV)如何突破细胞核建立感染,这一发现的意义超出了HIV生物学的范畴。
要感染细胞,HIV 必须进入目标细胞,并到达位于细胞中心的细胞核,在那里产生足够的遗传密码拷贝来感染其他细胞。为了安全地完成这一任务,这种病毒会构建一层保护性蛋白外衣——衣壳(capsid),以抵御宿主为消灭它而设置的免疫防御系统。在此之前,完整的衣壳究竟如何穿过嵌在核膜上的核孔进入细胞核一直是个谜。然而,这项新研究揭示了HIV衣壳如何进入核孔屏障通道。

科学家揭示HIV进入细胞核并引发感染机制
图片来源:Nature, 2024, doi:10.1038/s41586-023-06969-7
Jacques博士说,“核孔复合体(nuclear pore complex)由多种蛋白组合而成。虽然小分子可以通过核孔复合体进出细胞核,但大体积货物的进出却受到限制。较大的蛋白需要与核转运体——伴侣蛋白,结合在一起,才能通过这种多层分子门,即核孔。”尽管HIV的衣壳比穿过核孔屏障通道的分子大一千倍,但它可以在没有伴侣蛋白的情况下通过核孔屏障通道。在细胞核中,伴侣蛋白——也称为核转运蛋白(karyopherins)与核孔复合体中间的屏障蛋白结合,使它们能够带着有效载荷进入核孔屏障通道的每一层。没有伴侣蛋白的大体积结构则被排除在这一入口之外,因为它们无法与核孔中的屏障蛋白连接。
doi:10.1016/j.cell.2023.12.002
CD4结合位点(CD4bs)是HIV-1包膜(Env)上的一个保守表位,其能被保护性的广谱中和性抗体(bnAbs)靶向作用,HIV-1疫苗并不会诱发CD4bs bnAbs,其原因有很多,包括多糖会阻断CD4bs,携带免疫原的合适原始B细胞的扩张,以及功能性抗体突变的选择等。近日,一篇发表在国际杂志Cell上题为“Vaccine induction of CD4-mimicking HIV-1 broadly neutralizing antibody precursors in macaques”研究报告中,来自杜克大学医学院等机构的科学家们通过研究表示,成功研发HIV疫苗的途径依赖于关键的第一步,即激活特定免疫细胞来诱导广谱中和性抗体的产生。
文章中,研究人员通过对猴子进行研究迈出了重要的一步,下一阶段他们将转向对人类进行试验;文章第一作者Kevin O. Saunders说道,这项研究证实了,在结构和遗传水平上,抗体与我们作为保护性HIV疫苗基础的人类抗体相似;如今我们的研究走在了正确的道路上,而从这里开始,我们只需要开始将疫苗的其它组分组合在一起进行相应的研究。
在早期研究工作中,研究人员从个体机体中分离出了自然产生的广谱中和性抗体,随后回溯到抗体和病毒所经历的改变,从而达到天然抗体及其在HIV包膜上的结合位点的原始起点。基于这些知识,研究人员设计出了一种特殊分子,其能诱发模拟天然抗体及其在HIV包膜上结合位点的抗体的产生。四年前研究者Saunders等人在Science杂志上发表文章指出,当猴子接种了这种工程化的免疫原后就会产生中和性抗体,但研究者并不确定是否这些抗体能像人类疫苗所需的广谱中和性抗体一样。
【9】Science:新研究表明要成功开发有效的HIV疫苗,可能需要促进CD8+T细胞产生的强烈的免疫反应
doi:10.1126/science.adg0514
近日,一篇发表在国际杂志Science上题为“HIV vaccines induce CD8+ T cells with low antigen receptor sensitivity”的研究报告中,来自美国国家过敏与传染病研究所等机构的科学家们通过研究发现,有效的HIV疫苗可能需要促使称为CD8+ T细胞的免疫细胞产生强烈反应,以保护人们免受HIV病毒感染。他们比较了过去的HIV疫苗研究参与者和即使在没有抗逆转录病毒疗法(ART)的情况下也能自然阻止HIV复制的HIV感染者——通常称为长期无进展者(long-term non-progressor, LTNP)或精英控制者(elite controller, EC)的免疫系统活性。
当 HIV 进入人体后,这种病毒通过侵入 CD4+ T 细胞开始破坏免疫系统,其中CD4+ T 细胞是一种白细胞,有助于协调人体对病原体的免疫反应。在大多数人体内,除非通过ART加以控制,否则HIV会继续复制并损害越来越多的 CD4+ T 细胞。在 LTNP/EC中,免疫系统似乎能迅速识别携带 HIV 的 CD4+ 细胞,并激活称为 CD8+ T 细胞的免疫细胞。CD8+ T 细胞会消灭携带HIV的 CD4+ 细胞,从而抑制血液中的HIV。
要成功开发有效的HIV疫苗或需要促进CD8+T细胞产生的强烈的免疫反应
图片来源:Science, 2023, doi:10.1126/science.adg0514。
有效的HIV疫苗旨在提供对HIV的持久保护性免疫力,或者如果最初的防御被绕过,则帮助长期控制体内的HIV,正如LTNP/EC中的那样。虽然有几种候选预防性HIV疫苗被设计成能刺激 CD8+ T 细胞活性,但在临床试验中它们并不能阻止HIV感染或控制病毒复制。了解和解决这种缺乏效果的问题是HIV疫苗研究的科学重点。
这些作者设计了他们的研究,以更好地了解以前的HIV疫苗接种者缺乏哪些 CD8+ T 细胞功能。他们将以前的 HIV 疫苗研究参与者的实验室样本与来自LTNP/EC的样本进行了比较。他们发现,HIV 疫苗接种者和 LTNP/EC都产生了大量能识别 HIV 的 CD8+ T 细胞。然而,与来自LTNP/EC的 CD8+ T 细胞不同的是,HIV 疫苗接种者的 CD8+ T 细胞无法提供必要的蛋白来消灭感染 HIV 的 CD4+ T 细胞。
【10】Nature:科学家揭示HIV结合宿主机体T细胞的又一奥秘
doi:10.1038/s41586-023-06762-6
HIV-1感染是由病毒包膜糖蛋白(Env)与细胞表面受体CD4结合而开启的,尽管目前研究人员已经确定了Env与CD4可溶性结构域复合体的高分辨率结构,但其在天然膜中的结合过程研究人员尚不清楚。近日,一篇发表在国际杂志Nature上题为“HIV-1 Env trimers asymmetrically engage CD4 receptors in membranes”的研究报告中,来自耶鲁大学医学院等机构的科学家们通过研究首次揭示了HIV与T细胞膜上的受体结合的关键步骤,这一研究发现或有望帮助开发治疗HIV感染的新型疗法。
目前并没有针对HIV的疫苗或治疗性手段,抗逆转录病毒疗法(ART)能帮助HIV感染者将病毒抑制到无法检测到的水平,但这些患者必须终生服药来控制病情,对于一些患者而言,药物的有效性会随着时间的推移而减弱,如今科学家们知道,HIV能首先通过结合名为CD4的细胞表面受体来感染宿主机体。利用一种称之为低温电子断层扫描(cryo-ET,cryogenic electron tomography)的技术,研究人员首次可视化地观察到了HIV-1如何与携带CD4受体的病毒样颗粒(VLP)相互作用,相关研究揭示了HIV-1和VLP膜蛋白之间的逐步相互作用,包括HIV-1与宿主结合的中间阶段的结构。
研究者Walther Mothes博士表示,我们的研究揭示了这种可怕的疾病是如何开始的早期阶段,以及其如何与受体结合随后将膜与T细胞融合的步骤;我们希望这一研究发现能帮助开发出新型抑制性HIV药物来特异性靶向作用这些HIV构象。如今研究人员从动物模型到单个分子进行研究调查了病毒如何扩散和引起人类疾病,这项最新研究中,研究人员利用小鼠白血病病毒(MLV)产生携带CD4受体的VLPs,随后他们利用cryo-ET技术观察到了HIV-1和VLPs的混合物,并研究了在膜上所发生的相互作用。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


